Le mécanisme de modification de la chromatine à longue distance dévoilé
L'acétylation des histones facilite la transcription des gènes et la réparation de l'ADN. Elle est réalisée par divers complexes multiprotéiques, parmi lesquels le complexe NuA4 dispose de la capacité remarquable d'acétyler ses cibles à distance de son site de recrutement. Dans un article publié dans Nature Structural and Molecular Biology, les scientifiques ont élucidé la structure atomique de NuA4, la façon dont il agit à distance et l’importance physiologique de cette activité à longue portée.
L’ADN, support de l’information génétique, s’enroule autour des protéines histones pour former la structure répétée du nucléosome. Certaines régions de l'ADN doivent néanmoins être accessibles pour permettre l'expression des gènes ou la réparation de l’ADN endommagé. C'est pourquoi les nucléosomes situés à proximité de ces sites sont généralement modifiés par acétylation, ce qui crée une forme décondensée, plus accessible, de l'ADN.
La seule enzyme histone acétylase essentielle à la survie de la levure est incorporée dans le complexe protéique NuA4. NuA4 est constitué de 12 sous-unités protéiques regroupés en quatre modules fonctionnels, reliés entre eux par la sous-unité Eaf1, qui joue le rôle d'armature, mais on dispose de peu d'informations structurales sur ce complexe. Il est intéressant de noter que le recrutement local de NuA4 se traduit par des profils d'acétylation s'étendant sur plusieurs nucléosomes, à des distances jusqu’à dix fois supérieures à la taille attendue de NuA4.
Plusieurs questions fondamentales restent sans réponse, notamment celle de savoir comment l'activité histone acétylase est intégrée dans le complexe et comment le module d’acétylation peut atteindre des nucléosomes situés à une grande distance. Cette propriété semble être partagée par d'autres assemblages protéiques chargés de modifier la chromatine, mais le mécanisme et l’importance fonctionnelle de celle activité restent débattus.
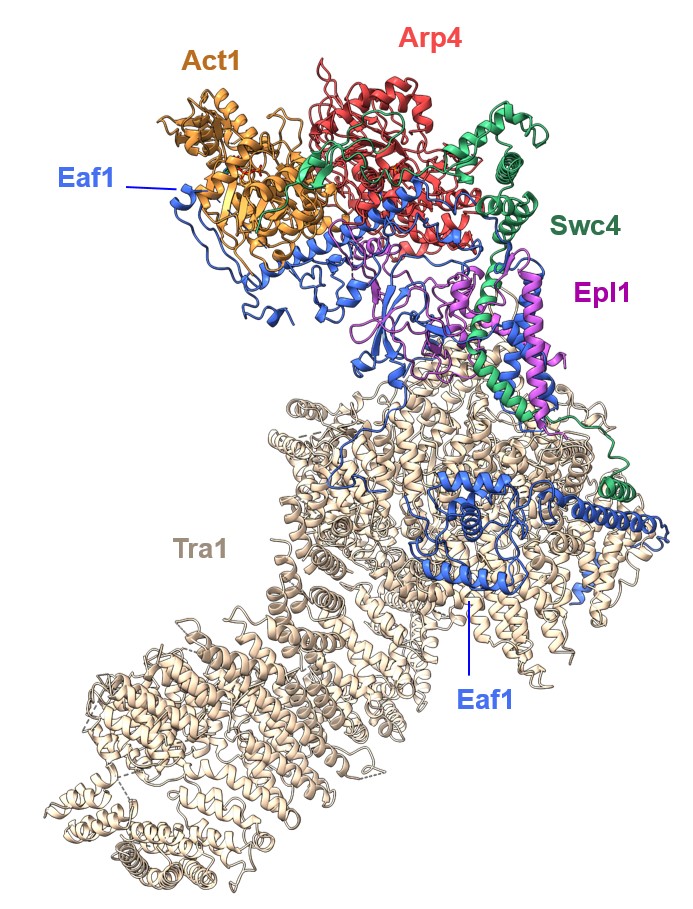
Dans cette étude, les scientifiques ont réussi à déterminer la structure atomique de NuA4 par cryomicroscopie électronique en utilisant, entre autres, les services des infrastructures nationales et européennes FRISBI et INSTRUCT. Un échafaudage composé de trois sous-unités entrelacées, dont la protéine Epl1, relie les différents modules de NuA4 et intègre le module d'acétylation des histones. La structure a révélé qu'une longue région non structurée de la protéine Epl1 relie le cœur de NuA4 au module d'acétylation. Ce lien flexible projette le module enzymatique à distance du cœur de NuA4 qui porte le module de recrutement et confère au complexe NuA4 son action à longue portée.
Les scientifiques ont également montré l’importance physiologique de cette région non structurée d'Epl1. En effet, lorsque ce lien flexible est raccourci, une réduction des niveaux d'acétylation des histones est observée à longue distance alors que l’acétylation à courte distance n’est pas affectée et certaines souches de levures ne peuvent survivre.
Ces travaux montrent l’importance de l'acétylation des nucléosomes sur de longues distances, et proposent un modèle mécanistique pour sa mise en œuvre.
En savoir plus :
Fréchard A, Faux C, Hexnerova R, Crucifix C, Papai G, Smirnova E, McKeon C, Ping FLY, Helmlinger D, Schultz P, Ben-Shem A. The structure of the NuA4-Tip60 complex reveals the mechanism and importance of long-range chromatin modification. Nat Struct Mol Biol. 2023 Aug 7. doi: 10.1038/s41594-023-01056-x.
Contact
Laboratoire
Institut de génétique et de biologie moléculaire et cellulaire – IGBMC (CNRS/Inserm/Université de Strasbourg)
1, rue Laurent Fries,
67404 Illkirch CEDEX