Le complexe CST, un acteur inattendu de la réparation de l’ADN
Réparer l’ADN endommagé est un processus essentiel à l’intégrité du génome, qui peut être dérégulé dans les cancers. Or, les voies de réparation sont multiples et complexes, et les facteurs qui les influencent ne sont pas tous connus. Dans cette publication parue dans Cell Genomics, des scientifiques ont découvert qu’un complexe protéique appelé CST, habituellement trouvé aux extrémités des chromosomes, permet de limiter les pertes massives d’information génétiques.
Réparer l’ADN pour protéger le génome
L’ADN endommagé représente un risque majeur pour la cellule et peut provoquer des mutations, certaines pouvant favoriser l’émergence de cancers. Les cellules possèdent donc plusieurs mécanismes de réparation pour préserver l’intégrité du patrimoine génétique. Selon le type de dommage et l’état de la cellule, différentes voies de réparation peuvent s’activer. Par exemple, lorsqu’une cassure touche les deux brins de l’ADN, une voie appelée « jonction des extrémités non homologues » (non-homologous end joining ou NEHJ en anglais) permet de recoller l’ADN cassé. On sait que le NHEJ intervient rapidement après une cassure, mais qu’il n’agit plus quand les extrémités d’ADN sont partiellement dégradées, laissant place à d’autres mécanismes de réparation.
Un rôle inattendu du complexe CST
Dans une étude publiée dans la revue Cell Genomics, des scientifiques montrent que le complexe CST (un ensemble composé de trois protéines composées de Cdc13, Stn1 et Ten1) joue aussi un rôle dans la réparation de l’ADN. Non seulement il favorise le NHEJ, mais il permet aussi à ce mécanisme de fonctionner plus tardivement qu’on ne le pensait, ouvrant la voie à un nouveau mécanisme de « réparation de secours ».
Le complexe CST se trouve habituellement aux extrémités des chromosomes linéaires, appelées télomères, pour les stabiliser. Perturber le complexe CST pour l’étudier provoque nécessairement des effets aux télomères. Pour tester le rôle de CST sans interférence des télomères, les scientifiques ont utilisé la levure de boulanger Saccharomyces cerevisiae. Dans une version particulière de cette levure, génétiquement modifiée pour ne posséder qu’un seul chromosome circulaire, les télomères sont absents. De plus, grâce à une enzyme, la nucléase Cas9, il est possible de provoquer une cassure double brin de façon contrôlée et d’observer la manière dont la cellule répare les dommages induits en absence ou en présence des protéines du complexe CST. Ainsi, ce système expérimental ingénieux permet d’étudier CST uniquement dans le cadre des cassures double brin d’ADN.
Une signature de mutation associée au complexe CST
En séquençant l’ADN réparé, les scientifiques ont observé des « cicatrices » : des mutations proches de la cassure caractéristiques du type de réparation utilisé. En comparant les résultats obtenus avec ou sans complexe CST, ils ont découvert que CST est indispensable pour un type particulier de mutation : les délétions de taille intermédiaire (perte de fragments d’ADN entre 5 et 100 paires de bases). Sans CST, ces petites délétions sont remplacées par des délétions massives de plusieurs milliers de bases, beaucoup plus dangereuses car elles effacent de larges portions d’information génétique. Ces résultats ont ensuite été vérifiés sur des levures « normales », avec 16 chromosomes linéaires et donc des télomères.
Un nouveau scénario moléculaire
Lorsque la première tentative de réparation par NHEJ échoue et que les extrémités de l’ADN cassé commencent à être dégradées sur un des deux brins, le complexe CST se fixe sur l’ADN endommagé. Il recrute le complexe Pola-primase, capable de resynthétiser partiellement l’ADN dégradé, limitant ainsi les dégâts. Cela permet alors au NHEJ de reprendre la main et de réparer la cassure, mais en générant une délétion de taille intermédiaire plutôt qu’une délétion massive.
Ces travaux montrent que le complexe CST définit une nouvelle forme de réparation par NHEJ, capable d’agir plus tardivement pour éviter les délétions trop importantes. Ce mécanisme agit comme une protection de secours, limitant les dégâts et contribuant à préserver la stabilité du génome. « Cette découverte met en lumière la complexité des systèmes de réparation de l’ADN et enrichit notre compréhension de la manière dont les cellules préviennent les altérations potentiellement délétères » concluent les auteur(e)s.
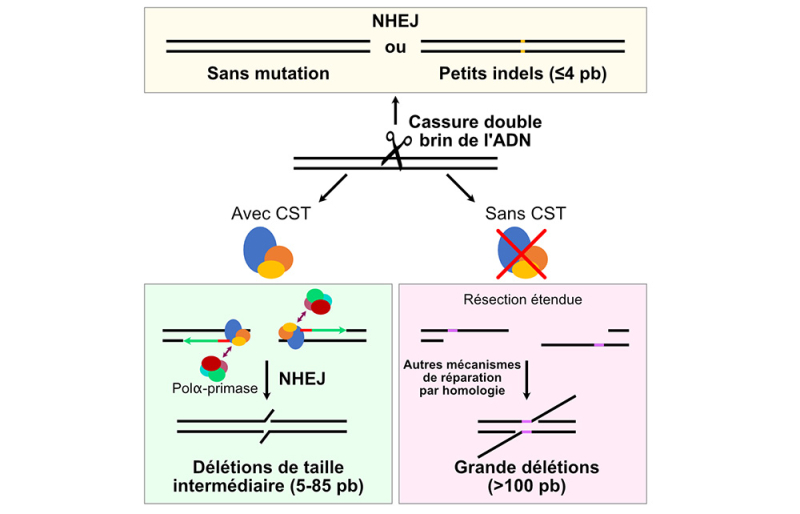
Figure : Après cassure de l’ADN, la voie de « jonction des extrémités non homologues » (ou NHEJ) permet de réparer rapidement l’ADN avec peu (petites insertions et délétions, ou « indels », de moins de 4 paires de bases) ou pas de mutation (voir encadré jaune en haut). Cette étude révèle que grâce au complexe CST et son interaction avec la Pola-primase, le NHEJ peut agir tardivement après dégradation partielle des extrémités de l’ADN cassé pour réparer en laissant comme cicatrice ou signature des délétions de taille intermédiaire (voir encadré vert en bas à gauche). En l’absence du complexe CST, cette voie de réparation de secours n’est plus disponible, les cellules endommagées peuvent mourir ou réparer l’ADN par d’autres mécanismes qui utilisent des séquences homologues mais qui conduisent à des délétions plus grandes et dangereuses pour l’intégrité du génome.
Contact
Laboratoire
Laboratoire de biologie computationnelle, quantitative et synthétique - CQSB (CNRS/Sorbonne Université)
Institut de biologie Paris-Seine
Sorbonne Université
Campus Pierre et Marie Curie
7-9 quai Saint Bernard
75005 Paris
