L’Auranofine : un traitement potentiel à double effet de la COVID-19
Les patients atteints d’une forme sévère de la COVID-19 présentent une immunité altérée, incapable de contrôler la propagation virale et une réponse inflammatoire exacerbée, pouvant entraîner la mort. Dans un article publié dans la revue iScience, les scientifiques montrent qu’un médicament utilisé autrefois dans la polyarthrite rhumatoïde agit à la fois en diminuant l'entrée du virus SARS-CoV-2 dans les cellules et en diminuant la réponse inflammatoire.
Malgré le développement de vaccins contre le SARS-CoV-2, nous faisons face à de nouvelles vagues de COVID-19 qui apparaissent suite à l'émergence de variants de la souche initiale résistants aux vaccins actuels ou à une infection antérieure. Pour lutter contre les formes graves de la maladie, l’industrie pharmaceutique a développé des anticorps ou des thérapies antivirales spécifiques pour la prévention et le traitement de la COVID-19. Ainsi, plusieurs produits ciblant l'entrée ou la réplication du virus ont obtenu des autorisations de mise sur le marché. Cependant, nous manquons de recul sur leur innocuité et leur efficacité. Par ailleurs, leur coût et leur mode d'administration limitent leur utilisation.
Dans cet article, la stratégie consiste à rechercher un médicament capable à la fois d'inhiber l'inflammation systémique qui crée la sévérité de la maladie et de ralentir la production de virus. Les scientifiques ont recherché de nouveaux inhibiteurs de NF-κB, un acteur majeur de la réponse inflammatoire. Ceci a été réalisé en effectuant un criblage d'une bibliothèque de médicaments approuvée par la Food and Drug Administration (FDA), basé sur une approche originale qui consiste à quantifier l’inhibition de structures intracellulaires requises pour activer NF-κB. Cette approche a permis d’identifier l’Auranofine, un sel d'or approuvé il y a 33 ans par la FDA pour le traitement de la polyarthrite rhumatoïde. Des expériences ont permis de montrer que l’Auranofine diminuait la réplication du virus SARS-CoV-2 dans des modèles cellulaires. Afin d’expliquer le mécanisme d’action, des expériences de biochimie et des techniques d'imagerie ont permis de mettre en évidence que l’Auranofine modifie la structure lipidique de la membrane cellulaire ce qui a pour effet de diminuer l’entrée du virus dans les cellules par un mécanisme appelé endocytose. D’autres expériences ont montré que l'Auranofine a un impact sur la diffusion membranaire du récepteur ACE2 utilisé par le SARS-CoV-2 pour infecter les cellules.
Ensemble, les données obtenues dans des lignées cellulaires qui représentent des modèles pour la biologie du SARS-CoV-2 montrent que l’Auranofine agit à plusieurs niveaux pour interférer avec l'entrée du SARS-CoV-2 et pour diminuer la réponse inflammatoire. Ainsi, l’Auranofine pourrait être une option thérapeutique intéressante pour améliorer les formes sévères de COVID-19. Des études in vivo utilisant des modèles plus physiologiques (comme les cultures d'organoïdes pulmonaires en 3D) et animaux (des souris génétiquement modifiées exprimant le récepteur ACE2 ou des hamsters adaptés au SARS-CoV-2) ainsi que des études cliniques permettraient de valider le potentiel thérapeutique de l’Auranofine.
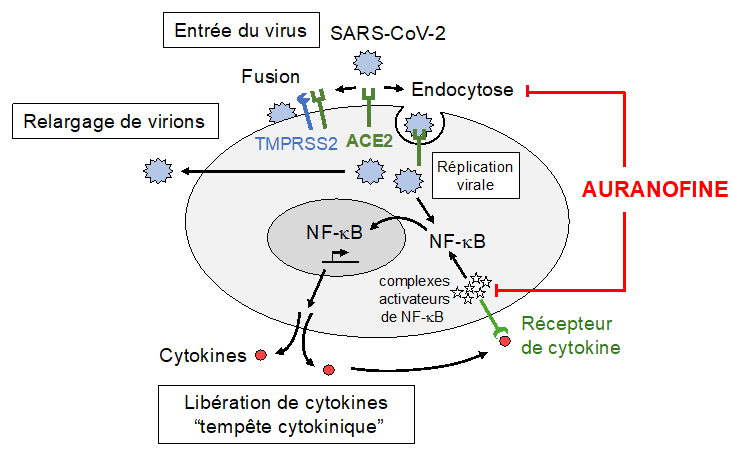
Figure : Modèle schématique montrant le rôle double de l’Auranofine dans l’inhibition de l'infection par le SARS-CoV-2 et la cascade inflammatoire. D’après ce modèle, l’Auranofine agit sur la diffusion d'ACE2, le principal récepteur du SARS-CoV-2 et sur les microdomaines lipidiques avec pour conséquence une diminution de l'endocytose, qui est un mécanisme important d'entrée du virus. L'Auranofine cible les événements précoces de la voie de signalisation NF-κB et inhibe son activation à la fois en réponse à l'entrée du virus et à la sécrétion de cytokines qui sont des médiateurs de l’inflammation.
Pour en savoir plus :
The FDA-approved drug Auranofin has a dual inhibitory effect on SARS-CoV-2 entry and NF-κB signaling.
Emmanuel Laplantine, Christine Chable-Bessia, Anne Oudin, Jitendryia Swain, Adèle Soria, Peggy Merida, Manon Gourdelier, Sarra Mestiri, Indira Besseghe, Erwan Bremaud, Aymeric Neyret, Sebastien Lyonnais, Cyril Favard, Philippe Benaroch, Mathieu Hubert, Olivier Schwartz, Maryse Guerin, Anne Danckaert, Elaine Del Nery, Delphine Muriaux, Robert Weil.
iScience 2 septembre 2022, https://doi.org/10.1016/j.isci.2022.105066
Contact
Laboratoire
Centre d’immunologie et des maladies infectieuses - CIMI-Paris (Sorbonne Université/Inserm/CNRS)
91 Boulevard de L'Hôpital
75013, Paris
Institut de recherche en infectiologie de Montpellier - IRIM (CNRS/Université de Montpellier)
1919 route de Mende
34293 Montpellier cedex 5