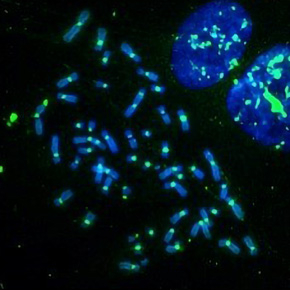
La stimulation de la réparation des cassures de l’ADN génère de l'instabilité génétique
Les défauts de réponse aux dommages à l'ADN induisent de l'instabilité génétique. Dans une étude publiée dans Nucleic Acids Research, des scientifiques montrent que, inversement, la kinase oncogénique AKT1/PKB, fréquemment dérégulée dans les cancers, induit de l’instabilité génétique en stimulant fortement la réparation des cassures double brins de l’ADN.
La réparation de l’ADN : un équilibre essentiel à la stabilité du génome
L'instabilité génétique est un facteur associé à l'apparition et au développement de cancers et d’autres maladies graves. Parmi les lésions les plus graves figurent les cassures double brin de l'ADN (CDB). Les CDB sont en outre utilisées dans différents processus physiologiques qui visent à générer de la diversité génétique, notamment lors de l'établissement du répertoire immunitaire ou de la méiose. Par conséquent, le contrôle de la réparation des CDB est un enjeu essentiel : elle doit maintenir la stabilité du génome, en permettant la diversité génétique, mais en évitant l'instabilité génétique.
Face aux stress génotoxiques, les cellules activent un mécanisme complexe : la réponse aux dommages de l'ADN (DDR : DNA Damage Response) qui orchestre la signalisation et la réparation de l’ADN. Toute défaillance dans la DDR peut entraîner une instabilité génétique, un vieillissement prématuré et une prédisposition au cancer. Un acteur central de cette réponse est le complexe MRN (MRE11-RAD50-NBS1) qui intervient très tôt pour activer la signalisation via la kinase ATM, indispensable à la coordination de la réparation des CDB.
La protéine kinase B (AKT1/PKB) est une kinase impliquée dans de nombreuses voies de signalisation cellulaire. Elle est fréquemment dérégulée dans divers cancers, notamment dans les formes sporadiques du cancer du sein et de l’ovaire, où son expression est souvent augmentée.
Étant donné que de nombreuses mutations impliquées dans les cancers héréditaires du sein ou de l’ovaire touchent des gènes de la DDR, les scientifiques se sont interrogés sur l’impact d’AKT1/PKB sur la stabilité du génome.
Un mécanisme inédit : l’hyperactivation de la réparation conduit à une instabilité génomique
Dans cette étude, publiée dans la revue Nucleic Acids Research, ils montrent que l'augmentation de l’activité AKT1/PKB induit une instabilité génétique et des réarrangements chromosomiques, observés dans plusieurs lignées cellulaires, cancéreuses ou non, avec différents tests biologiques et par l'analyse de bases de données génomiques issues de cBioPortal sur le cancer du sein.
Les scientifiques ont identifié un mécanisme par lequel AKT1/PKB favorise activement l'instabilité génétique. En phosphorylant la protéine MRE11 sur trois sites, AKT1/PKB favorise l'assemblage du complexe MRN, stimulant la signalisation ATM et la réparation des cassures via la religature des extrémités d’ADN (end-joining, EJ).
Or, cette hyperactivation de la réparation n’est pas sans conséquence : elle engendre des réarrangements intra et inter-chromosomiques (translocations, délétions, inversions), source d’instabilité.
Cette observation contraste avec de précédents travaux où les phosphorylations de MRE11, par différentes kinases et sur différents sites, étaient plutôt associées à une inhibition de son activité, notamment en réduisant son affinité à l’ADN et le recrutement d’ATM sur les sites endommagés. Ici, c’est la première fois que la phosphorylation de MRE11 stimule au contraire la signalisation et la réparation, mais au prix d’une instabilité accrue.
Une nouvelle cible thérapeutique
Les résultats sont cohérents avec l'instabilité génomique élevée observée dans les tumeurs surexprimant AKT1/PKB dans les bases de données du génome du cancer (cBioportal). Ils fournissent également une explication moléculaire à la résistance aux radiations observée dans les tumeurs AKT1/PKB-positives.
En effet, la réparation des CDB constitue une arme à double tranchant : bien qu’indispensable pour maintenir l’intégrité du génome et la résistance aux radiations, elle peut aussi provoquer des réarrangements génomiques en reliant les cassures distantes entre elles.
Ainsi, cette étude montre que l’hyperactivation de la DDR, et non sa simple défaillance, peut, elle aussi, générer de l’instabilité génétique. Cela souligne l’importance d’un équilibre strict dans les processus de signalisation et de réparation de l’ADN.
Enfin, ces travaux mettent en lumière MRE11 comme une nouvelle cible thérapeutique potentielle, qui pourrait être exploitée pour sensibiliser les tumeurs AKT1/PKB-positives à des traitements génotoxiques, comme la radiothérapie.
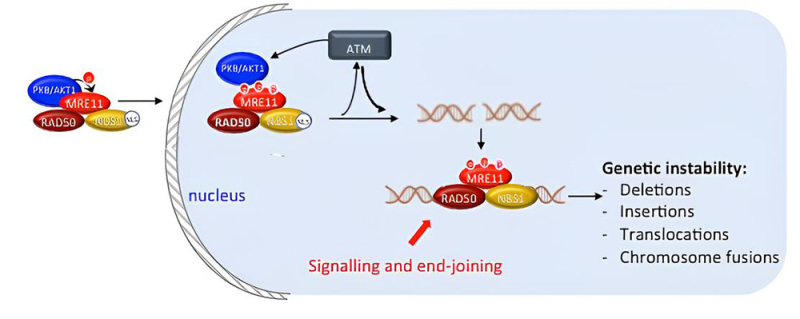
Figure : AKT1/PKB phosphoryle MRE11 (3 résidus) ce qui favorise l'assemblage du complexe MRN et son transport dans le noyau (grâce à la séquence de localisation nucléaire portée par NBS1). Ce complexe active la voie ATM, ce qui stimule la signalisation et la réparation des dommages à l'ADN, en particulier les cassures double-brin (CDB). La ligature de CDB éloignées entraîne inéluctablement des réarrangements génomiques, tels que des translocations, des inversions, de grandes délétions et des fusions chromosomiques.
Référence : Genome rearrangements induced by the stimulation of end-joining of DNA double strand breaks through multiple phosphorylation of MRE11 by the kinase PKB/AKT1. Guirouilh-Barbat J, Boueya IL, Gelot C, Pennarun G, Granotier-Beckers C, Dardillac E, Yu W, Lescale C, Rass E, Ariste O, Siaud N, Renouf B, Millet A, Puget N, Bertrand P, de la Grange P, Brunet E, Deriano L, Lopez BS.
Nucleic Acids Research, 6 juin 2025, DOI : 10.1093/nar/gkaf468.
Contact
Laboratoire
Institut Cochin (CNRS/Université de Paris Cité/Inserm)
Institut Cochin,
24 rue du Faubourg St. Jacques,
75014 PARIS - France