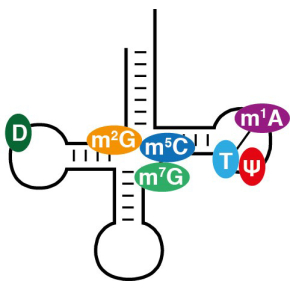
La RMN comme nouvel outil pour étudier les modifications des ARN
Des décennies d'exploration dans le domaine des modifications de l'ARN ont révélé plus de 160 décorations différentes incorporées sous forme de modifications post-transcriptionnelles dans les molécules d'ARN. L'étude des modifications des ARN, aussi appelée l'épitranscriptomique, constitue un domaine de recherche en pleine expansion, dont les avancées sont portées par des développements méthodologiques qui améliorent la détection ou la caractérisation de ces modifications. Dans le but d'apporter de nouveaux outils pour étudier les modifications des ARN, les chercheurs montrent que la spectroscopie de résonance magnétique nucléaire (RMN) peut être utilisée pour étudier la temporalité d'introduction des modifications post-transcriptionnelles dans les ARN de transfert (ARNt). Cette étude est publiée dans la revue Nature Communications.
Parmi les molécules d'ARN, les ARNt présentent non seulement la plus grande variété de décorations post-transcriptionnelles, mais également la plus grande densité de modifications par molécule. Par exemple, chez la levure Saccharomyces cerevisiae, de 9 à 16 modifications sont généralement retrouvées sur chaque molécule d'ARNt (pour une longueur moyenne de 76 nucléotides), ce qui représente un taux de modification d'environ 12-20 %. Nombre de ces modifications sont introduites à des positions proches les unes des autres, ce qui permet des interactions potentielles et des régulations lors de leur incorporation. L'étude de ces circuits de régulation dans l'introduction des modifications post-transcriptionnelles est essentielle pour comprendre les fonctions globales des modifications dans la régulation de l'expression génétique et dans l'adaptation aux conditions de stress. Elle est cependant compliquée car il est techniquement difficile de suivre la maturation des ARNt en temps réel à l'échelle nucléotidique.
Dans cette étude, une utilisation originale de la RMN en extrait cellulaire a permis d'étudier étape par étape la maturation de l’ARNt-phenylalanine de levure. En suivant la maturation de cet ARNt par des expériences RMN résolues en temps, les chercheurs ont constaté que certaines modifications sont introduites dans un ordre séquentiel défini et que la chronologie est contrôlée par des circuits de régulation qui connectent entre eux certains événements de modification.
Ces travaux, menés en collaboration avec l’Université Louis-et-Maximilien de Munich, mettent en évidence pour la première fois un circuit de régulation dans l’une des boucles, la boucle T, des ARNt de la levure. Ce circuit, qui implique trois modifications extrêmement conservées dans la boucle T des ARNt (Psi55, T54 et m1A58), impose un ordre séquentiel dans l'introduction de ces modifications et pourrait jouer un rôle dans le contrôle qualité de la biosynthèse de cette région cruciale des ARNt. Cette étude démontre également que la RMN constitue un outil puissant pour étudier l'incorporation des modifications dans les ARN et ouvre des perspectives pour l'utilisation de la RMN en épitranscriptomique afin d’étudier divers aspects de la maturation des ARNt, et plus généralement les modifications des ARN.
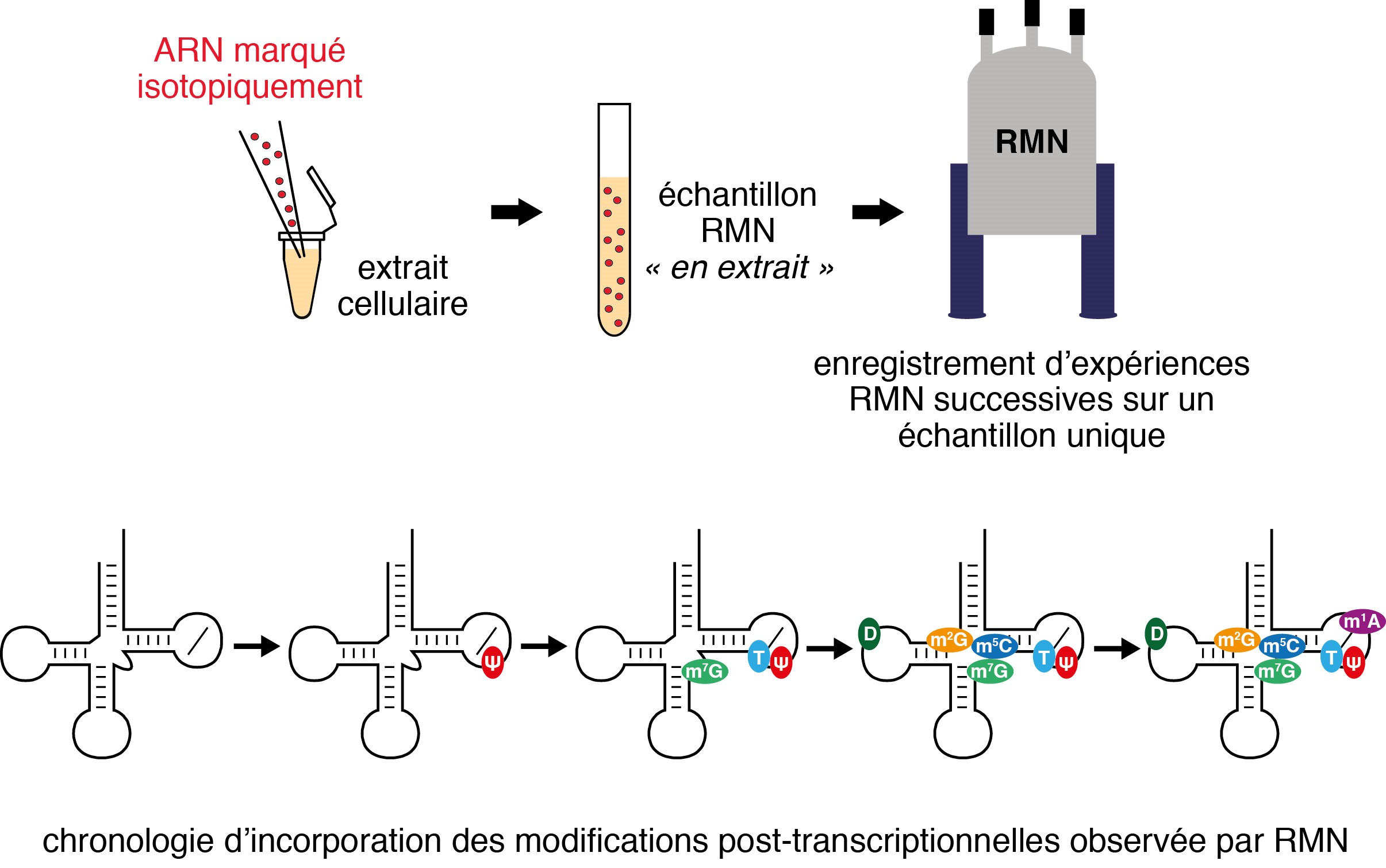
Les expériences RMN résolues en temps permettent de déterminer la chronologie d’incorporation des modifications post-transcriptionnelles dans l’ARNt étudié. Au niveau de la boucle T, les modifications sont introduites dans l’ordre suivant : Psi55, puis T54 et finalement m1A58.
© Pierre Barraud
En savoir plus :
Time-resolved NMR monitoring of tRNA maturation.
Barraud P, Gato A, Heiss M, Catala M, Kellner S, Tisné C.
Nat Commun. 2019 Jul 29;10(1):3373. doi: 10.1038/s41467-019-11356-w