La protéine Pho92 module le niveau des ARN messagers contenant des résidus m6A et contrôle la recombinaison méiotique
De nombreux sites m6A, modifications internes les plus répandues des ARN messagers (ARNm) eucaryotes, ont été catalogués mais leurs fonctions restent généralement inconnues. Dans cette étude publiée dans la revue Nucleic Acids Research, les scientifiques ont identifié les sites m6A liés par la protéine Pho92 chez la levure et montré qu’avec ce facteur ils modulent le niveau d’ARNm codant des facteurs de la recombinaison des gènes lors de la méiose.
Les « résidus m6A » sont formés par la méthylation post-transcriptionnelle de certaines adénosines dans les ARNm. Ces modifications sont déposées de manière ciblée et approximativement une adénosine sur mille est ainsi modifiée. Les m6A contribuent à la régulation de l'expression des gènes, notamment en stimulant la dégradation des ARNm. Diverses techniques de séquençage ont identifié des milliers de sites modifiés, mais on ne sait pas quelle fraction de ces sites est fonctionnelle ni précisément comment ils agissent. Chez la levure Saccharomyces cerevisiae, les m6A sont retrouvés durant la méiose et la sporulation qui constituent l’équivalent de la gamétogenèse des mammifères.
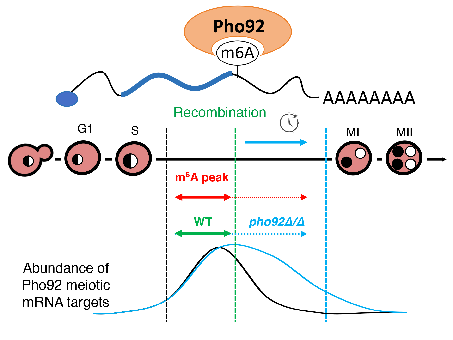
Dans cet article, les scientifiques étudient la protéine Pho92 de la levure Saccharomyces cerevisiae , un facteur dont la fonction physiologique n’avait pas encore été caractérisée. Pho92, qui reconnait les sites m6A, constitue en effet un outil pour comprendre la fonction de ces derniers. Ils montrent que Pho92 est spécifiquement exprimé lors de la méiose et que son absence perturbe ce processus. En l’absence de Pho92, les transcrits d’un groupe de gènes codant des facteurs de recombinaison méiotique perdurent plus longtemps que dans des cellules sauvages. En combinant le séquençage d'ARN à haut débit avec la cartographie des sites ciblés par Pho92 dans les ARNm, les scientifiques observent que ce facteur contribue à leur régulation négative au début de la première des deux divisions méiotiques. Plus particulièrement, la mutation de sites m6A individuels dans des ARNm-clés ciblés par Pho92 modifie le contrôle temporel de leur expression. De manière contre-intuitive, l’élimination d’un seul site m6A présent dans l’ARNm REC8 codant pour un facteur essentiel de la recombinaison méiotique est suffisant pour retarder la méiose. En l’absence de m6A, Pho92 ne présente aucune liaison significative aux ARNm indiquant ainsi que sa fonction dépend entièrement de cette modification.
Cette étude apporte une meilleure compréhension des mécanismes par lesquels les modifications des ARNm contrôlent leur expression. Certaines des informations obtenues pourront être transposée chez les mammifères et les plantes où des facteurs homologues à Pho92 sont présents. Ces résultats pourraient ainsi contribuer à accroitre notre compréhension de la biologie des cellules germinales ainsi qu’à une explication de certains défauts de fertilité causés par l’altération de protéines de lecture du m6A.
Pour en savoir plus :
The S. cerevisiae m6A-reader Pho92 promotes timely meiotic recombination by controlling key methylated transcripts.
Scutenaire J, Plassard D, Matelot M, Villa T, Zumsteg J, Libri D, Séraphin B.
Nucleic Acids Resarch 8 aout 2022. doi: 10.1093/nar/gkac640.
Contact
laboratoire
Institut de Génétique et de Biologie Moléculaire et Cellulaire (CNRS / Inserm/ Université de Strasbourg)
1 rue Laurent Fries
67400 Illkirch Graffenstaden (France)
