La protéine BRCA1 gardienne des centromères
Des scientifiques mettent en évidence un nouveau rôle de la protéine suppresseur de tumeurs BRCA1 comme gardien de l’intégrité des centromères. Ces régions du génome sont cruciales pour la séparation correcte des chromosomes pendant la mitose. Ces travaux sont publiés dans la revue Cell Death & Disease.
Les centromères sont constitués de séquences d’ADN répétées en tandem dites a-satellites qui sont transcrites par l’ARN Polymérase II. Les ARN non-codants produits (cenRNAs) participent à la structuration de la chromatine centromérique caractérisée par la présence du variant de l’histone H3 appelé CENP-A. Des anomalies fonctionnelles ou structurelles des centromères peuvent induire une distribution incorrecte du nombre de chromosomes entre les cellules filles et des aberrations chromosomiques, comme des fusions, qui participent à la carcinogenèse, la sénescence ou la mort cellulaire.
La protéine BRCA1 est connue pour ses mutations qui prédisposent au cancer du sein. Elle assure le maintien de la stabilité du génome en participant à la correction de certains dommages à l’ADN. La localisation constitutive de BRCA1 au niveau des centromères en absence de tout stress exogène avait déjà été montrée, mais les mécanismes sous-tendant le recrutement et la fonction de BRCA1 aux centromères n’étaient pas connus.
Dans cette étude, les scientifiques montrent que la localisation de BRCA1 au centromère dépend de la présence de R-loops, structures nucléiques à trois brins comprenant des hybrides ADN/ARN produits lors de la transcription. Les R-loops peuvent avoir des rôles physiologiques mais leur accumulation non contrôlée est une menace pour l’intégrité du génome. Les chercheurs ont établi que BRCA1 est nécessaire pour limiter l’accumulation de R-loops au niveau des séquences a-satellites en permettant le recrutement aux centromères d’une enzyme dissociant les R-loops, la protéine SETX. L’accumulation de R-loops en absence de BRCA1 conduit à une diminution des histones CENP-A aux centromères, à l’augmentation de la transcription des cenRNAs et à la formation de cassures double-brin centromériques. Ces cassures centromériques observées en absence de BRCA1 sont associées à un processus d’hyper-recombinaison des séquences a-satellites dépendant de la protéine RAD52, qui participe à l’instabilité des régions centromériques et à la ségrégation anormale des chromosomes. L’ensemble de ces données met en évidence le rôle clef de BRCA1 dans le maintien de l’identité et de la stabilité des centromères, régions cruciales pour la ségrégation des chromosomes donc pour la stabilité du génome.
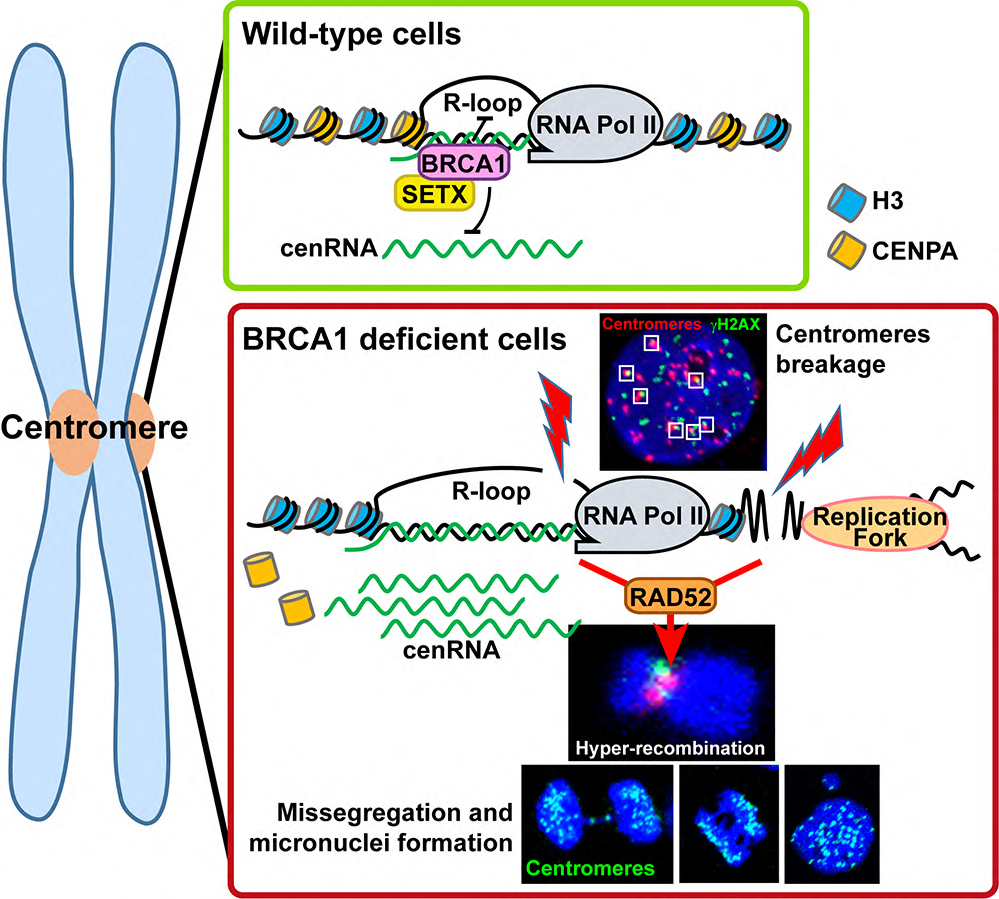
Figure : Schéma illustrant le rôle de la protéine BRCA1 dans le maintien de la stabilité des centromères. Les images de microscopie confocale montrent la présence de cassures double-brin (en vert) au niveau des centromères (en rouge), le phénotype d’hyper-recombinaison des séquences centromériques (visualisé sur chromosome mitotique), les défauts de ségrégation des chromosomes, ainsi que la formation de micronoyaux dans des cellules humaines déficientes en BRCA1.
Pour en savoir plus :
BRCA1 prevents R-loop-associated centromeric instability
Racca, C., Britton, S., Hédouin, S., Francastel, C., Calsou, P. and Larminat, F.
Cell Death & Disease 1er octobre 2021. https://doi.org/10.1038/s41419-021-04189-3
Contact
laboratoire
Institut de Pharmacologie et Biologie Structurale (CNRS/Université de Toulouse)
31077 Toulouse