La mélatonine maternelle est un horoscope endocrinien
La mélatonine, une hormone dont la production nocturne varie pendant l’année, synchronise les fonctions biologiques avec les saisons chez l’adulte. L’équipe de Valérie Simonneaux à l’Institut des neurosciences cellulaires et intégratives, montre comment les changements saisonniers de la mélatonine maternelle, connue pour traverser la barrière placentaire, agit sur la production d’hormones thyroïdiennes dans l’hypothalamus des fœtus de rongeurs pour programmer leur développement futur. Cette étude a été publiée le 17 juillet 2017 dans la revue PNAS
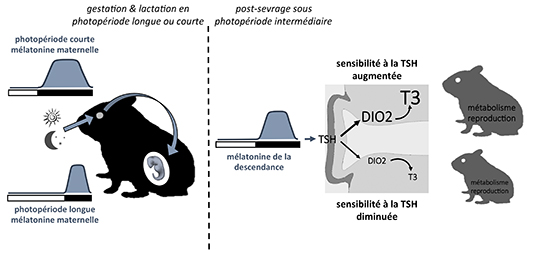
La mélatonine est une hormone des saisons car sa production nocturne est d’autant plus importante que les nuits sont longues (en hiver). Son rôle dans la synchronisation saisonnière des fonctions biologiques comme la reproduction, la prise alimentaire ou le sommeil est bien établi chez les adultes. L’équipe de Valérie Simonneaux, en collaboration avec David Hazlerigg à l’Université de Tromso (Norvège), a étudié les mécanismes par lesquels la mélatonine maternelle affecte également le développement fœtal et ceci différemment selon les saisons.
Avant la naissance, les fœtus ne produisent pas de mélatonine mais ont déjà des récepteurs fonctionnels qui peuvent être activés par la mélatonine maternelle capable de traverser la barrière placentaire. La mélatonine maternelle régule différemment le développement métabolique et reproducteur de petits hamsters sibériens selon que la période de gestation et de lactation de leurs mères s’est déroulée en photopériode courte (hivernale) ou en photopériode longue (estivale). Les chercheurs ont montré que la mélatonine maternelle agit sur l’hypophyse du fœtus en développement pour contrôler, via la production de thyréostimuline (TSH), l’expression d’enzymes impliquées dans le métabolisme des hormones thyroïdiennes et localisées dans des cellules gliales spécialisées, les tanycytes de l’hypothalamus. Ainsi à la naissance, les petits issus de mères gestantes en photopériode courte ont une production d’hormones thyroïdiennes hypothalamiques inférieure à celle des petits issus de mères gestantes en photopériode longue.
Cette régulation différentielle par la mélatonine maternelle programme la sensibilité des tanycytes à la TSH après la naissance. En effet, lorsque les hamsters sont ensuite élevés en conditions environnementales similaires, les jeunes issus de mères gestantes en photopériode courte ont une sensibilité des tanycytes à la TSH augmentée qui se traduit par une production accrue d’hormones thyroïdiennes localement dans l’hypothalamus. Cette hyperthyroïdie locale est associée à une accélération du développement des systèmes métabolique et reproducteur des petits nés en photopériode courte.
Les résultats de cette étude décrivent une nouvelle voie transplacentaire codant un calendrier interne qui programme le développement des fonctions cérébrales.
Cette étude a bénéficié d'un co-financement du CNRS et de l'Université de Strasbourg.
En savoir plus
-
Maternal photoperiod programs hypothalamic thyroid status via the fetal pituitary gland.
Cristina Sáenz de Miera, Béatrice Bothorel, Catherine Jaeger, Valérie Simonneaux, and David Hazlerigg
PNAS 2017 ; published ahead of print July 17, 2017, doi:10.1073/pnas.1702943114