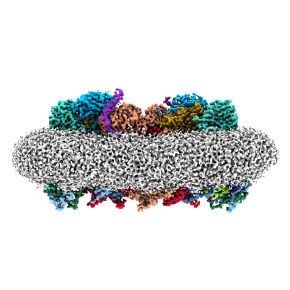
La machinerie protéique de la respiration devient visible
Dans une étude publiée dans la revue Nature Communications, des chercheurs fournissent une analyse par cryo-microscopie électronique à haute résolution d’une protéine membranaire clef qui constitue une des machines moléculaires de la chaîne respiratoire. Ces connaissances sur le fonctionnement des molécules de la chaîne respiratoire observées sur les bactéries Actinobacteria sont transférables à de nombreux organismes et peuvent aider à développer de nouveaux agents actifs contre des bactéries apparentées.
L'oxygène et le sucre sont la base de la vie des animaux, des plantes, des champignons et de nombreuses bactéries. Le processus métabolique appelé respiration permet de transformer les aliments en énergie pour les cellules. L'adénosine triphosphate (ATP) est la monnaie énergétique de la cellule. Cette molécule est obtenue lors de la respiration et transfère l'énergie des aliments à tous les processus de la cellule. Grâce aux processus de la chaîne respiratoire, l'adénosine diphosphate est transformée en ATP, riche en énergie. Pour ce faire, les complexes protéiques de la chaîne respiratoire créent une force motrice électrochimique à travers une membrane avec des électrons et des protons dans un processus chimico-physique compliqué qui est alimenté par la combustion du sucre.
Les scientifiques se sont concentrés sur deux complexes de chaînes respiratoires fusionnés en un supercomplexe dans un groupe de bactéries appelé Actinobacteria. En utilisant la cryo-microscopie électronique, ils ont visualisé pour la première fois avec une précision inégalée la structure et le fonctionnement de cet ensemble de machines protéiques. Ceci comprend notamment la visualisation des substrats et des molécules d’eau impliquées dans le processus moléculaire. En élucidant la structure, les chercheurs éclairent simultanément le fonctionnement du supercomplexe. Ainsi, ils montrent que la pompe à protons du complexe est très similaire à celle des humains mais la partie où les électrons sont pris en charge par la quinone, un transporteur d'électrons, présente de nettes différences chez la bactérie. Outre une explication fondamentale des processus respiratoires, cette analyse pourrait aider à la mise au point de nouveaux médicaments contre les actinobactéries pathogènes comme Mycobacterium tuberculosis ou Corynebacterium diphtheriae en interférant avec leur chaîne respiratoire.
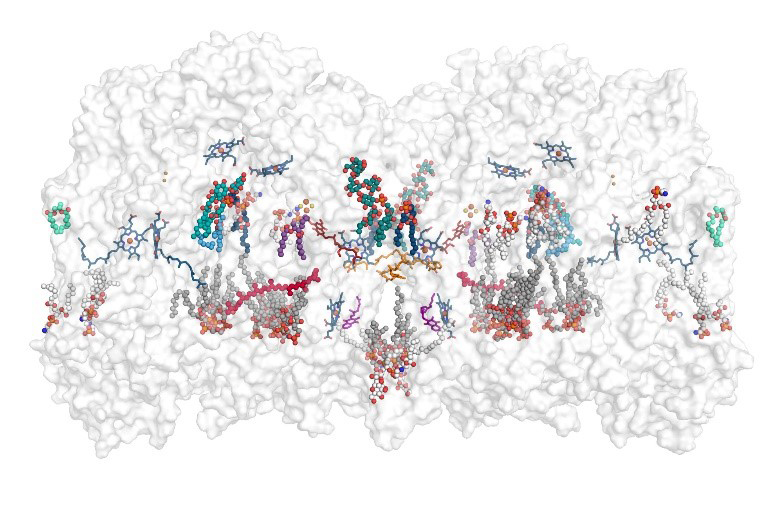
Figure : Visualisation du supercomplexe cytochrome bcc-aa3 par cryo-microscopie électronique, elle amène une compréhension détaillée de la structure moléculaire, de la fonction des enzymes et a même permis de visualiser les substrats et molécules d‘eau impliqués dans la chaîne respiratoire.
Pour en savoir plus :
Structural basis for safe and efficient energy conversion in a respiratory supercomplex
Kao WC, Ortmann de Percin Northumberland C, Cheng TC, Ortiz J, Durand A, von Loeffelholz O, Schilling O, Biniossek ML, Klaholz BP, Hunte C.
Nat Commun. 27Jan 2022 . doi: 10.1038/s41467-022-28179-x.
Contact
Laboratoires
Institute of biochemistry and molecular biology (CIBSS)
Centre for integrative biological signalling studies, Faculty of medicine
University of Freiburg
Stefan-Meier-Straße 17
D-79104 Freiburg
Institut de génétique, biologie moléculaire et cellulaire, IGBMC (CNRS/Inserm/Université de Strasbourg)
1 rue Laurent Fries
67404 Ilkirch