La friction : un acteur clé dans la morphogenèse cellulaire
Dans un article publié dans la revue PNAS, les scientifiques démontrent, en utilisant un système biomimétique mimant la contraction cellulaire, que les forces de résistances (friction), produites par l’interaction entre le squelette cellulaire, cytosquelette et son environnement, pourraient jouer un rôle essentiel dans les modifications de la forme des cellules. Ces découvertes nous aident à mieux comprendre les mécanismes fondamentaux responsables de la morphogenèse cellulaire. Cela pourrait également aider les scientifiques à créer de meilleurs modèles biomimétiques (synthétiques) pour expliquer comment les cellules se polarisent, bougent ou changent de forme.
Au cours du processus de morphogénèse, les cellules sont sous l’action de forces mécaniques d'origines diverses, qui influencent leur forme. C’est une véritable lutte avec d’un côté, les forces internes du cytosquelette de la cellule qui comprennent l’actine et la myosine (qui agissent comme des muscles internes de la cellule), et des forces externes provenant de l’environnement de la cellule. De nombreuses études se sont penchées sur le rôle des forces internes, générées par la nucléation de l’actine, un mécanisme d’auto-assemblage permettant la formation de filaments d’actine, et par l’intercalation des molécules de myosine, les moteurs moléculaires, qui permettent la contraction de la cellule et donc son changement de forme. Mais la compréhension du rôle directeur des forces externes résistives au cours de ce processus était jusqu’alors limitée notamment car elles sont compliquées à isoler et donc à étudier dans un contexte cellulaire.
La symétrie de déformation peut être dominée par les forces de friction
Pour s’affranchir de la complexité du milieu cellulaire, les auteurs ont utilisé un système biomimétique minimal, composé uniquement de protéines et où la friction entre un réseau d’actine et son substrat peut être contrôlée de manière précise.
Les scientifiques ont fabriqué des surfaces spéciales, composées de verre ou d’une bicouche lipidique, sur lesquelles des réseaux composés d’actine et de myosine pouvaient évoluer de manière différente, selon que la friction était élevée ou non. Ils ont ainsi observé qu’une friction faible entre un réseau d’actine et sa surface permettait au réseau de se contracter plus vite et de manière plus coordonnée que lorsque la friction est élevée.
Des perspectives dans l’étude de la forme et du mouvement des cellules
Ils ont alors développé une nouvelle technique permettant de générer de nouvelles surfaces spéciales hétérogènes, comportant des zones à friction élevée juxtaposées à des zones à friction réduite. Sur ces motifs hétérogènes, la déformation pendant la contraction n'était plus symétrique par rapport à la géométrie initiale mais biaisée vers la région à friction élevée. Ils ont ainsi pu démontrer grâce au résultat de ces expériences et à une modélisation mathématique, que la symétrie peut être dominée par les forces de friction du réseau contractile avec son environnement.
Ces résultats suggèrent que la contribution des forces résistives, telles que les forces visqueuses le long de la surface des cellules, peut être aussi importante que celle des forces actives dans la déformation du réseau et devrait être prise en compte dans les modèles mécaniques décrivant la régulation de la forme et du mouvement des cellules.
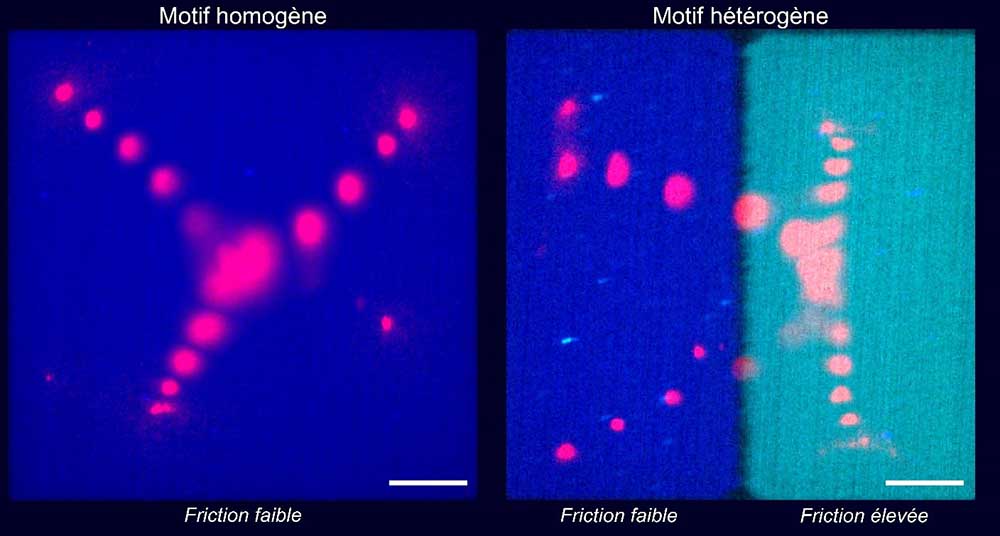
Figure : Projection temporelle de la trajectoire de la myosine (en rouge) sur un motif de friction homogène ou hétérogène pendant la contraction du réseau d’actine. Le carré (ou rectangle) bleu représente un micro-patron avec une friction faible. Le rectangle cyan représente un micro-patron avec une friction élevée. Barre d’échelle : 10 µm.
En savoir plus :
Friction patterns guide actin network contraction (PNAS (120 (39) e2300416120) 2023). Alexandra Colin*, Magali Orhant-Prioux*, Christophe Guérin*, Mariya Savinov*, Wenxiang Cao, Benoit Vianay,Ilaria Scarfone, Aurelien Roux, Enrique M. De La Cruz, Alex Mogilner, Manuel Théry#, Laurent Blanchoin#. https://doi.org/10.1073/pnas.2300416120
Contact
Laboratoires
Laboratoire de physiologie cellulaire et végétale – LPCV (CNRS/CEA/IEP/Inrae)
17 rue des Martyrs
38054 Grenoble
UMRS1160 (Inserm/Université Paris Cité/CEA)
Institut de Recherche Saint Louis, CytoMorpho Lab, Hôpital Saint Louis,
75010 Paris