La conception moléculaire assistée par ordinateur pour soigner les leucémies aigües
La leucémie aigüe lymphoblastique T est connue pour son taux élevé de rechute et sa résistance aux traitements standards, limitant considérablement les chances de survie à long terme. Dans cet article, publié dans le journal Nature Communications, les scientifiques présentent la découverte d'un candidat-médicament développé par conception moléculaire assistée par ordinateur ciblant la déoxycytidine kinase, une enzyme clé de la voie de synthèse des nucléotides, récemment apparue comme cible d’intérêt dans ce type de cancer.
Les leucémies aigües lymphoblastiques T (LAL-T) présentent de nombreux cas de rechute et de résistance après le traitement standard, avec un pronostic de 5% de survie à 5 ans. Il est donc nécessaire de proposer des thérapies innovantes. La prolifération incontrôlée des cellules lymphoïdes T cancéreuses entraîne une forte demande métabolique, en particulier afin de supporter un niveau de synthèse d’ADN élevé. Cette synthèse est assurée par deux voies : la voie principale, dite ‘de novo’ et la voie secondaire, dite ‘de sauvetage’. La déoxycytidine kinase (dCK) est récemment apparue comme une cible d’intérêt lorsque l'on souhaite limiter la prolifération des cancers dépendant de la voie de sauvetage.
Dans cet article, publié dans le journal Nature Communications, les scientifiques présentent la découverte d'un médicament potentiel ciblant dCK, à l’aide d’une stratégie s’appuyant sur la conception de molécules actives assistée par ordinateur, couplée à des validations biologiques in vitro, sur cellule et chez la souris.
Dans une étude précédente, les scientifiques avaient identifié dCK comme la cible secondaire d'un inhibiteur de tyrosine kinase (TKi) nommé masitinib. Dans ce nouveau travail, ils ont émis l'hypothèse qu'un niveau accru d'interaction entre le masitinib et dCK pourrait déclencher l'inhibition de l'enzyme.
Ils ont donc appliqué au masitinib une approche de conception de molécules bioactives appelée DOTS (Diversity-oriented target-focused synthesis). Elle a pour but d'augmenter la complémentarité et donc la force de l'interaction entre les molécules développées et la cible biologique. Au cours de ce travail, ils ont synthétisé et évalué une chimiothèque de 74 composés et ont obtenu un candidat médicament appelé OR0642, 1000 fois plus puissant que la molécule initiale.
En combinaison avec de la thymidine, un inhibiteur physiologique déjà connu de la voie ‘de novo’, le composé dit ‘tête de série’, OR0642, inhibe dCK et la voie ‘de sauvetage’. Les souris greffées avec des cellules tumorales de patients atteints de LAL ayant bénéficié de cette thérapie ont doublé leur taux de survie. Cette thérapie fait appel au concept de létalité synthétique où seule la combinaison de deux molécules ciblant sélectivement ces deux voies est toxique pour les cellules tumorales. Ce résultat démontre la preuve de concept de cette stratégie, l’absence de toxicité liée au concept de létalité synthétique, et son potentiel thérapeutique dans un cancer particulièrement agressif.
Dans l'ensemble, le présent travail démontre une approche innovante de conception de médicaments, où le repositionnement d'un médicament (masitinib, un TKi ciblant c-KIT) sur une nouvelle cible (dCK) peut être utilisée comme point de départ d'une approche semi-automatisée de conception de médicaments qui pourrait être appliquée à d'autres cibles en cancer ou pour d'autres pathologies.
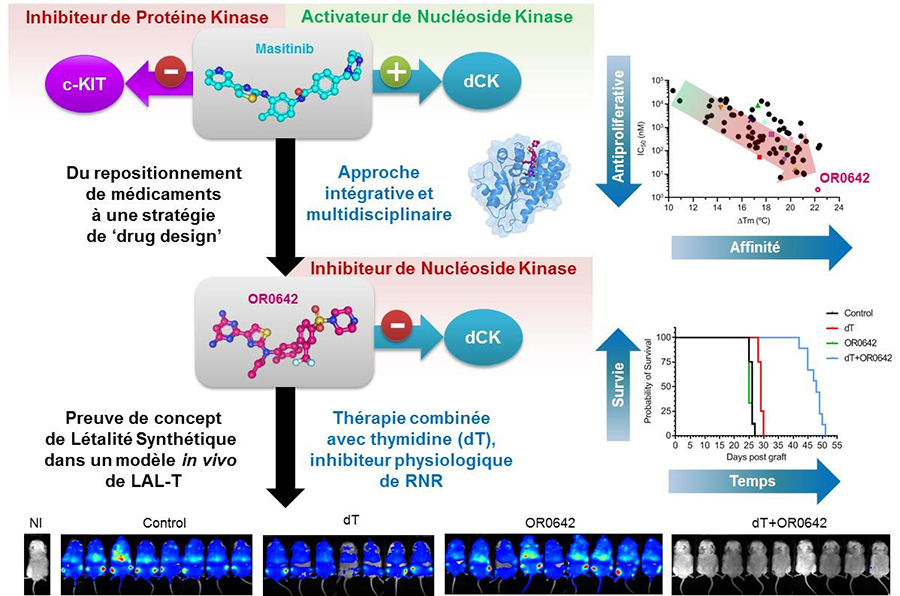
Figure : Approche utilisée pour le développement d’inhibiteurs de dCK utilisant une stratégie multidisciplinaire et itérative s’appuyant sur la conception de molécules assistée par ordinateur, couplée à des validations biologiques in vitro, sur cellule et dans l'animal.
Pour en savoir plus :
From a drug repositioning to a structure-based drug design approach to tackle acute lymphoblastic leukemia.
Saez-Ayala M, Hoffer L, Abel S, Ben Yaala K, Sicard B, Andrieu GP, Latiri M, Davison EK, Ciufolini MA, Brémond P, Rebuffet E, Roche P, Derviaux C, Voisset E, Montersino C, Castellano R, Collette Y, Asnafi V, Betzi S, Dubreuil P, Combes S, Morelli X.
Nat Commun. 2023 May 29;14(1):3079. doi: 10.1038/s41467-023-38668-2. PMID: 37248212; PMCID: PMC10227015.
Contact
Laboratoire
Centre de recherche en cancérologie de Marseille (CNRS/Inserm/Université Aix-Marseille/Institut Paoli-Calmettes)
27 Boulevard Leï Roure,CS30059
13273 Marseille Cedex 09