La chorégraphie de l’ADN ribosomique : sa mobilité permet sa réparation
Les cassures double-brin de l’ADN font partie des lésions les plus toxiques pour la cellule car elles sont souvent à l’origine de cancers. Les gènes en cours de transcription sont plus enclins à subir ce type de lésions, sans pour autant que les processus de réparation de ces cassures soient compris. En étudiant la région la plus activement transcrite de notre génome, l’ADN ribosomique, les chercheurs mettent en lumière son mécanisme particulier de réparation. Ces résultats sont publiés dans la revue Genes & Development.
Notre ADN subit de nombreuses agressions externes qui mènent à des dommages menaçant l’intégrité du génome. Parmi ces dommages, les cassures double-brin de l'ADN sont considérées comme les lésions les plus toxiques pour la cellule car elles peuvent conduire à des mutations et des réarrangements chromosomiques, événements à l’origine de cancers. A contrario des lésions causées par des attaques externes, des travaux récents indiquent que les menaces sont également internes à la cellule, causées par son activité métabolique normale, ce qui entraine des cassures double-brin préférentiellement localisées dans les gènes dont la transcription est active. La réparation de ces gènes dits « actifs » reste néanmoins un sujet encore très peu étudié.
Les chercheurs se sont donc penchés sur la réparation de la région la plus transcrite de notre génome : l’ADN ribosomique, qui code pour les ARN de structure du ribosome au sein d’un compartiment particulier du noyau des cellules, le nucléole. En plus d’être « hypertranscrit », l’ADN ribosomique est composé d’unités d'ADN répétées, ce qui constitue une véritable menace pour l’intégrité du génome car le moindre déséquilibre (variation du nombre de répétitions ou leurs réarrangements) pourrait mettre en péril l’homéostasie cellulaire, notamment via une production anormale des ribosomes qui assurent la synthèse des protéines, essentielles à toute fonction cellulaire. On peut d’ailleurs noter qu'une instabilité de l’ADN ribosomique a déjà été associée au cancer et au vieillissement prématuré.
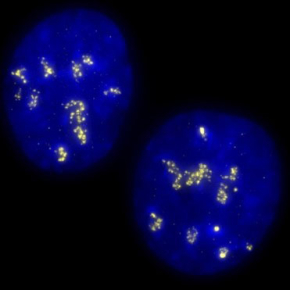
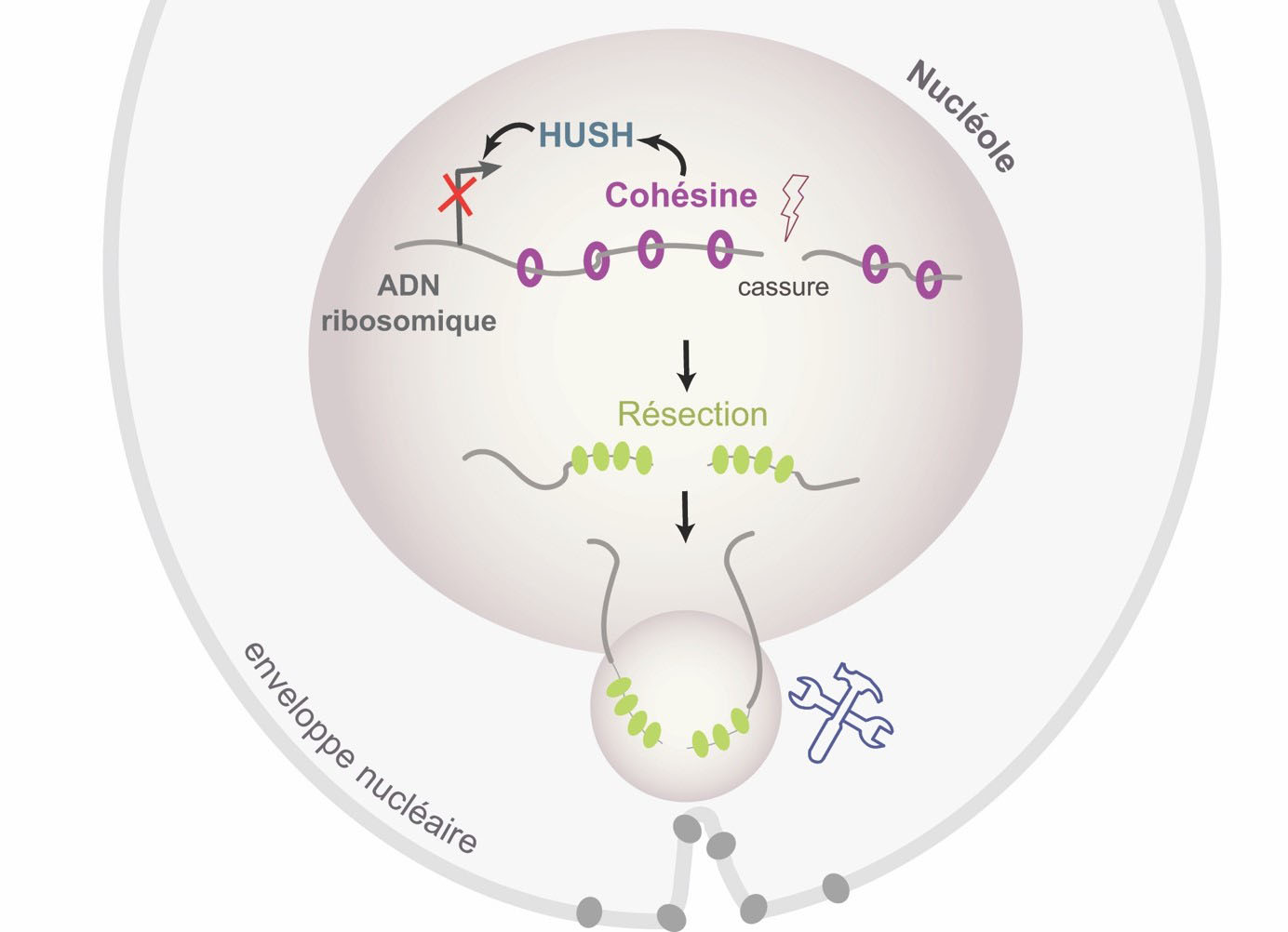
Afin, de comprendre les mécanismes de réparation de l’ADN ribosomique, les chercheurs ont eu recours à un modèle cellulaire (DIvA) permettant l’induction de cassures double-brin à des positions connues dans le génome humain, et notamment dans l’ADN ribosomique. Ils ont montré que les cassures double-brin au sein de l’ADN ribosomique causaient l’arrêt de sa transcription, d’une manière dépendante de protéines architecturales des chromosomes (les cohésines) et d’un complexe réprimant l’expression génique via des modifications épigénétiques (appelé HUSH). Contrairement à ce qui avait été proposé, l’arrêt de la transcription n’est pas suffisant pour promouvoir le mouvement observé de l’ADN ribosomique endommagé vers l’extérieur du nucléole. Les chercheurs ont mis en évidence que cette mobilité requiert également la formation d’ADN simple brin (résection), de manière étendue, permettant ainsi une réparation des cassures par le mécanisme de recombinaison homologue.
Cette étude montre également que des invaginations de l’enveloppe nucléaire touchent fréquemment le nucléole et que la mobilité de l’ADN ribosomique vers l’extérieur du nucléole assurant sa réparation serait un processus actif impliquant des protéines des squelettes nucléaire et cytoplasmique.
Ces résultats sont une première étape dans l’identification des protéines qui protègent l’ADN ribosomique contre l’instabilité génomique.
© : Aline Marnef
Pour en savoir plus:
A cohesin/HUSH- and LINC-dependent pathway controls ribosomal DNA double-strand break repair.
Marnef A, Finoux AL, Arnould C, Guillou E, Daburon V, Rocher V, Mangeat T, Mangeot PE, Ricci EP, Legube G.
Genes Dev. 2019 Aug 8. doi: 10.1101/gad.324012.119. [Epub ahead of print]