Métalloenzymes : comment des acides aminés distants du site actif impactent leur réactivité
En savoir plus sur le site de CNRS Chimie
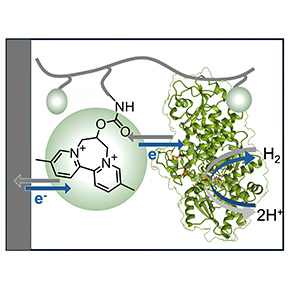
Le développement de l'hydrogène comme alternative aux énergies fossiles se heurte encore à plusieurs verrous technologiques. Dans un article publié dans PNAS, des scientifiques ont conçu un dispositif innovant permettant de protéger et d’utiliser des hydrogénases, enzymes bactériennes impliquées dans le métabolisme de l’hydrogène, pour produire une électricité décarbonée moins coûteuse.
L'hydrogène dit "vert" est produit par électrolyse de l'eau, un procédé qui utilise de l’électricité pour séparer l’eau en hydrogène et oxygène. Cet hydrogène peut ensuite être utilisé dans une pile à combustible pour produire de l’électricité sans émettre de gaz à effet de serre. Il s’agit donc d’un vecteur énergétique propre, c’est-à-dire un moyen de stocker et de restituer l’énergie de façon durable.
Cependant, bien que cette technologie soit connue depuis longtemps, son développement à grande échelle reste complexe. L’un des principaux défis consiste à concevoir des catalyseurs efficaces et peu coûteux capables de produire et d’oxyder le dihydrogène (H₂). Aujourd’hui, ces catalyseurs reposent sur le platine, un métal rare et cher, déjà très sollicité dans d’autres domaines industriels.
Dans la nature, de nombreuses bactéries utilisent elles aussi l’hydrogène comme source ou vecteur d’énergie. Elles le produisent grâce à des enzymes appelées hydrogénase, dont les sites actifs, indispensables à la réaction, sont constitués de métaux abondants et bon marché, comme le fer ou quelquefois le nickel.
Ces hydrogénases suscitent un fort intérêt, car elles pourraient servir de catalyseurs naturels dans des dispositifs énergétiques. Le problème, c’est qu’elles sont fragiles : la plupart ne supportent pas l’oxygène ni les environnements dits oxydants. Trouver une hydrogénase “idéale”, à la fois stable, résistante et peu coûteuse à produire, est donc un objectif de recherche majeur. Et même si cette enzyme parfaite n’a pas encore été découverte, les progrès récents sont considérables.
Les biologistes de nombreuses équipes dans le monde ont compris comment ces enzymes sont fabriquées dans les bactéries et ont développé des méthodes permettant de produire des hydrogénases dites "à fer" à bas coût et en grande quantité. Par ailleurs, l’exploration de la biodiversité des hydrogénases a permis d’en découvrir de nouvelles aux propriétés inattendues.
L'une d’entre elles, produite par la bactérie anaérobie Clostridium beijerinckii, s’est révélée particulièrement intéressante car son site actif grâce à un mécanisme moléculaire particulier, n'est pas détruit lorsqu'il est exposé à l'oxygène. Mais cette enzyme semblait peu utile dans un contexte de catalyse de l'oxydation de l'hydrogène, parce que cette protection rend l'enzyme inactive vis-à-vis de l'hydrogène...
Dans un article publié dans la revue PNAS, des scientifiques décrivent un dispositif qui permet de fixer cette hydrogénase particulière sur une électrode dans des conditions qui conservent sa stabilité en présence d'oxygène. Ils ont pour cela incorporé l’enzyme dans un film dont l’épaisseur est de l’ordre de la dizaine de micromètres, constitué d’un dendrimère (un polymère ramifié) capable de transférer des électrons. En ajustant précisément les propriétés de ce matériau, ils ont réussi à faire en sorte que la protection contre l’oxygène n’empêche plus la réaction avec l’hydrogène.
Cette réussite, protégée par un brevet, est le fruit d’un travail interdisciplinaire combinant physicochimie, synthèse de polymères, biochimie et modélisation cinétique. Elle ouvre la voie à de nouvelles générations de piles à combustibles biologiques plus robustes, plus durables et potentiellement moins coûteuses.
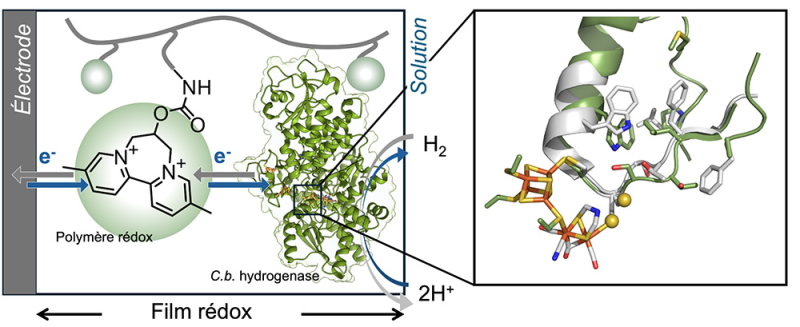
Figure : L'hydrogénase de C. beijerinckii est stable à l'oxygène parce qu'un changement de conformation déclenché par la présence d'hydrogène (à droite) protège son site actif. Son incorporation dans un film d'un certain polymère rédox (à gauche) lui permet de conserver sa stabilité à l'air et son activité d'oxydation d'hydrogène, dans un dispositif catalytique d'oxydation de l'hydrogène qui est donc très robuste, mais aussi très bon marché.
En savoir plus : D.T. Filmon, J. Jaenecke, M. Winkler, V. Fourmond, C. Léger, & N. Plumeré, Turning the FeFe hydrogenase from Clostridium beijerinckii into an efficient H2 oxidation catalyst using a redox-active matrix, Proc. Natl. Acad. Sci. U.S.A. 122 (41) e2514698122, https://doi.org/10.1073/pnas.2514698122 (2025).
En savoir plus sur le site de CNRS Chimie
Bioénergétique et ingénierie des protéines - BIP (Aix-Marseille Université/CNRS)
31 Chemin Joseph Aiguier
13009 Marseille