Infertilité : des spasmes ovocytaires perturbent l’héritage maternel
Dans une étude, publiée dans la revue Developmental Cell, les scientifiques montrent l’importance du cortex ovocytaire, une zone frontière située à la périphérie de l’ovocyte, dans le maintien de l’intégrité du contenu cytoplasmique du gamète femelle. Des anomalies dans sa constitution provoque une désorganisation de toutes les réserves mises en place pendant la croissance ovocytaire indispensable au bon développement du jeune embryon.
La fécondité diminue dans le monde entier et de nombreux couples se tournent vers les techniques de procréation médicalement assistée pour concevoir des bébés. L’héritage maternel est constitué de protéines, d’ARNs et d’organelles. Il est transmis par le gamète femelle, l’ovocyte, à sa descendance, et joue un rôle déterminant dans la fécondité. Les ovocytes transmettent cet héritage maternel par le biais de divisions très asymétriques en taille ; ils expulsent de tous petits globules polaires, conservant ainsi leur énorme cytoplasme contenant tout ce qui sera nécessaire pour le début du développement de l’embryon.
Le cortex des ovocytes est une zone frontière à la périphérie de la cellule qui joue un rôle essentiel dans le maintien de la forme cellulaire mais aussi lors de la fécondation par le spermatozoïde. Il constitue un élément important dans le contrôle des divisions asymétriques de l’ovocyte de souris. En effet, lorsque les ovocytes se préparent à subir leur première division, pendant une étape importante de la fin de la méiose, ce cortex s’épaissit. Pendant cette phase, le réseau d’actine du cortex, un élément clé du cytosquelette essentiel à la plupart des processus cellulaires, devient plus épais grâce à une sorte de déclencheur appelé complexe Arp2/3. Cet épaississement d’actine aide à repousser une protéine appelée Myosine II vers l’intérieur de la cellule et à ramollir le cortex. Le ramollissement favorise le déplacement de l’ensemble du fuseau de division vers la périphérie, pour une division asymétrique des ovocytes nécessaire pour le bon développement embryonnaire futur.
Des contractions ayant des effets délétères sur la fertilité féminine
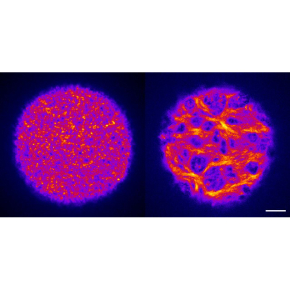
Pour mieux comprendre les implications de ce processus, les scientifiques ont cherché à observer ce qui se passe lorsque cet épaississement du cortex est défectueux. Grâce à différentes approches collaboratives et interdisciplinaires, mêlant génétique, biologie cellulaire, moléculaire, et approche par Intelligence Artificielle (IA), ils ont observé que l’absence d’actine branchée, nucléée grâce au complexe Arp2/3, entraine des contractions du cortex de l’ovocyte. Ces dernières ayant des effets délétères sur la qualité du gamète femelle. Les ovocytes de souris dépourvus génétiquement du complexe Arp2/3 présentent une importante réorganisation de l'actine corticale lorsqu’ils entrent en division. Cette dernière forme des faisceaux de microfilaments épais, qui induisent des contractions corticales sans précédent. L’énergie de ces contractions est transmise au cytoplasme, par le biais de flux cytoplasmiques aberrants, qui entraînent une altération de l'organisation et de l'activité des organelles, comme les mitochondries ou les granules corticaux.
Le positionnement des granules corticaux au cortex est en effet altéré et la capacité des ovocytes à éviter la polyspermie (pénétration de plusieurs spermatozoïdes dans l’ovocyte) s’en trouve affectée, conduisant à une réduction de la fertilité des souris. Une analyse par IA montre que des contractions similaires sont observées dans des ovocytes humains collectés comme sous-produits lors de procédures de Fécondation In Vitro (FIV).
Cette analyse révèle aussi que les contractions du cortex corrèlent avec une augmentation des flux du cytoplasme mais ne coïncident pas avec des défauts d’assemblage du fuseau ou de l'aneuploïdie (gain ou perte d’un chromosome entier) chez la souris et l'Homme. Ces travaux mettent en évidence un effet multi-échelle reliant l’architecture des microfilaments corticaux, les contractions du cortex et l'organisation cytoplasmique affectant la qualité des ovocytes, avec des implications pour la fertilité féminine.
En effet, bien que l'aneuploïdie (anomalie dans le nombre de chromosomes) soit l'anomalie la plus courante observée dans les ovocytes humains et que son taux augmente avec l'âge maternel, les scientifiques démontrent que les contractions corticales, et les éventuels défauts d’organelles cytoplasmiques associés, à l’image de ceux observés dans le modèle murin, pourraient représenter une nouvelle forme d'anomalie ovocytaire en lien avec l'infertilité.
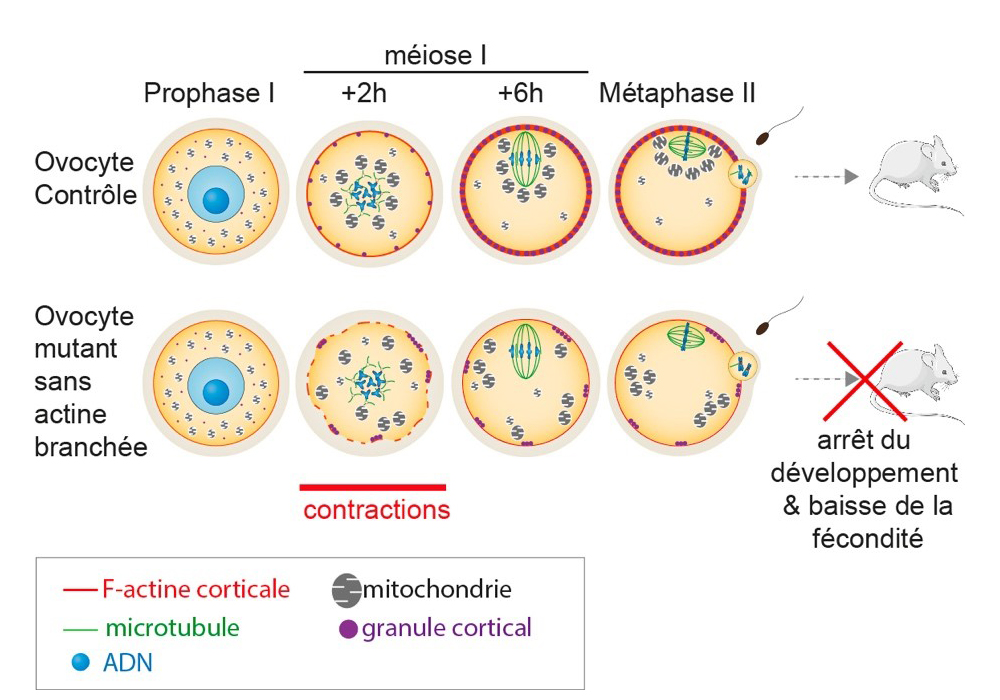
Figure : L’absence de microfilaments corticaux nucléés par le complexe Arp2/3 dans les ovocytes mutants sans actine branchée induit une réorganisation du cortex ovocytaire et l’apparition de contractions corticales. Ces contractions corticales favorisent l’apparition de flux cytoplasmiques ectopiques qui impactent le mouvement et l’architecture des organelles (mitochondries, granules corticaux). Le cycle cellulaire ovocytaire n’est pas impacté dans sa dynamique : sortie normale des ovocytes de leur arrêt en Prophase de première division de méiose (Prophase I) suivie d’une progression normale de la première division de méiose (méiose I) et d’un arrêt en métaphase de seconde division de méiose (méiose II). Cependant, la fécondation des ovocytes mutants est réduite ainsi que leur développement précoce. La fertilité des souris produisant ces ovocytes mutants est également diminuée.
En savoir plus :
Nikalayevich E, Letort G, de Labbey G, et al. Aberrant cortex contractions impact mammalian oocyte quality. Developmental Cell. 2024 Feb:S1534-5807(24)00047-9. DOI: 10.1016/j.devcel.2024.01.027. PMID: 38387459.
Contact
Laboratoire
Centre interdisciplinaire de recherche en biologie - CIRB (CNRS/Collège de France/Inserm)
Collège de France
11 place Marcelin Berthelot
75005 Paris, France