HEATR3 : un chaperon (pour globule) rouge
L'anémie de Diamond-Blackfan est une maladie rare caractérisée par un défaut de production des globules rouges. Dans un article paru dans la revue Blood, les scientifiques ont mis en lumière une nouvelle forme de la maladie liée à la perte de fonction du gène HEATR3 dont le produit chaperonne la synthèse et l'assemblage d'une protéine ribosomique.
L'anémie de Diamond-Blackfan (ADB) est une maladie génétique rare qui touche environ 1 nouveau-né sur 200 000. Cette pathologie se traduit généralement par le développement d’une anémie sévère dans les trois premiers mois après la naissance due à une forte diminution des progéniteurs érythroïdes, les cellules qui vont se différencier en globules rouges. Cette maladie a été associée à la mutation de différents gènes codant des protéines ribosomiques qui, associés avec des ARN, structurent les ribosomes, "usines" de synthèse des protéines. La maladie s'observe dès qu'un allèle du gène sur les deux porte la mutation (hétérozygotie) et le déficit quantitatif (haploinsuffisance) en protéines ribosomiques qui en résulte altère la formation et la fonction des ribosomes, ce qui fait de l'ADB un archétype de "ribosomopathie".
Le ribosome étant une machinerie ubiquitaire dans l'organisme, comment expliquer l'altération spécifique de l'érythropoïèse dans l'ADB ? Il a été montré qu'une baisse du nombre de ribosomes pouvait entraîner un défaut ciblé de synthèse et de stabilité du facteur de transcription GATA-1, qui joue un rôle clé pour la différenciation des globules rouges. De plus, l'altération de la formation des ribosomes entraîne un stress pour les cellules (stress ribosomique) et déclenche l'activation de la protéine suppresseur de tumeur p53, dont l'action inhibitrice sur la prolifération pourrait également interférer avec l'érythropoïèse.
Malgré des avancées très importantes, chez plus de 20% des patients, aucun des gènes connus n'avait pu être mis en cause. Grâce au travail conjoint de plusieurs services de génétique au sein du consortium RiboEurope, financé par le programme conjoint européen sur les maladies rares (EJPRD), des variants d'un nouveau gène, HEATR3, ont été détectés chez six patients aux Pays-Bas, en Turquie et en France. Les chercheurs ont démontré que, comme son homologue chez la levure, HEATR3 s'associe à la protéine ribosomique RPL5/uL18 dès sa synthèse dans le cytoplasme et chaperonne cette protéine pendant son transport vers le noyau de la cellule. La perte de fonction de HEATR3 altère la synthèse des ribosomes, en accord avec un déficit d'incorporation de RPL5 dans les ribosomes en formation.
Le gène RPL5 est lui-même un de ceux les plus fréquemment mutés dans l'ADB et on pourrait s'attendre à ce que les patients portant des variants de HEATR3 ou de RPL5 présentent des phénotypes similaires. Pourtant, les patients HEATR3 se distinguent par une anémie moins sévère et plusieurs présentent un déficit intellectuel, ce qui correspond à une forme peu commune de la maladie. De fait, l'analyse de cultures de progéniteurs érythroïdes issus de ces patients ne fait apparaître ni activation de p53, ni déficit de GATA-1, ce qui suggère qu'un autre mécanisme physiopathologique est à l'œuvre.
En plus d'identifier un nouveau gène impliqué dans l'ADB, ce travail met en lumière une forme singulière de la maladie et procure une nouvelle piste pour comprendre comment les ribosomopathies affectent plus spécifiquement certains tissus ou lignages cellulaires.
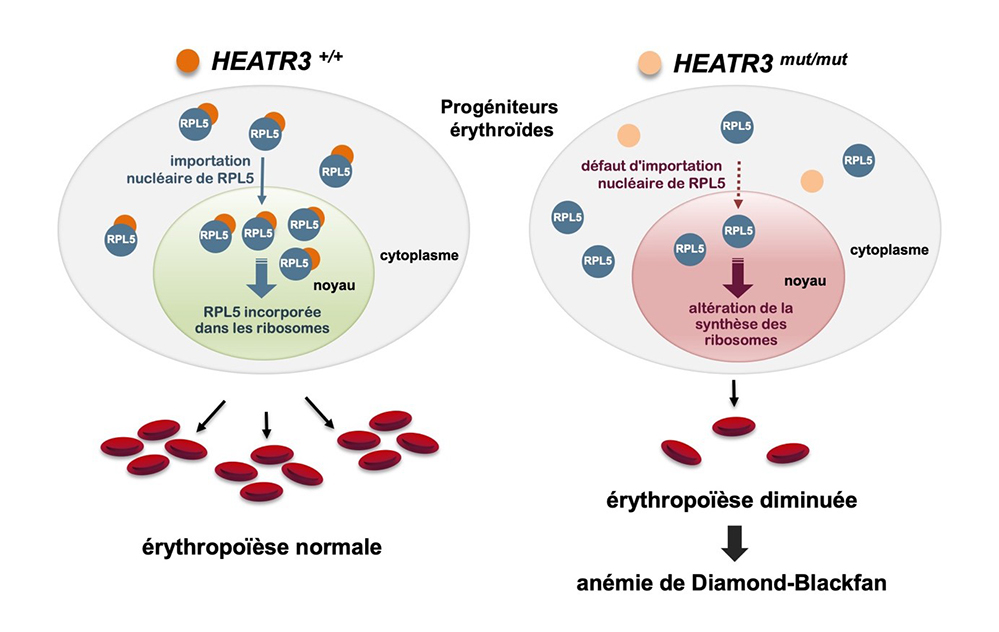
Figure : Mécanisme proposé pour expliquer l'impact de la mutation de HEATR3 dans la survenue de l'anémie de Diamond-Blackfan. La protéine HEATR3 s'associe à la protéine ribosomique RPL5 dans le cytoplasme et la chaperonne jusque dans le noyau cellulaire où elle est incorporée dans la grande sous-unité ribosomique en formation. La perte de fonction de HEATR3 limite le transport de RPL5 vers le noyau et perturbe la synthèse des ribosomes. Ce stress limite la production des hématies à partir des progéniteurs érythroides.
Pour en savoir plus :
HEATR3 variants impair nuclear import of uL18 (RPL5) and drive Diamond-Blackfan anemia
O'Donohue MF, Da Costa LM, Lezzerini M, Unal S, Joret C, Bartels M, Brilstra E, Scheijde-Vermeulen M, Wacheul L, De Keersmaecker K, Vereecke S, Labarque V, Saby MJ, LeFevre SD, Platon J, Montel-Lehry N, Laugero N, Lacazette E, van Gassen K, Houtkooper RH, Simsek-Kiper PO, Leblanc TM, Yarali N, Cetinkaya A, Akarsu NA, Gleizes PE, Lafontaine DLJ, MacInnes AW
Blood, 25 février 2022. https://doi.org/10.1182/blood.2021011846
Contact
Laboratoire
Centre de Biologie Intégrative de Toulouse
Unité de biologie moléculaire, cellulaire et du développement (MCD) – (CNRS/Université Paul Sabatier)
118 route de Narbonne
31062 Toulouse Cedex 9