Good ROS Bad ROS : quand les espèces réactives de l'oxygène protègent l’intégrité du génome
Une étude publiée dans Cell Death & Differenciation décrit un nouveau type de réponse aux dommages à l'ADN : des fibroblastes humains en culture adaptent leur réponse à l'intensité du stress réplicatif. En réponse à un stress de faible intensité, la réplication et le cycle cellulaire ne sont pas bloqués, contrairement à ce qui se passe suite à un stress de forte intensité, mais, pour prévenir l’accumulation de dommages oxydatifs pré-mutagènes les cellules contrôlent la production enzymatique de ROS (reactive oxygene species) qui induisent le programme de détoxication des ROS, y compris des ROS exogènes. Cette réponse adaptative protège la stabilité du génome.
Les cellules sont en permanence soumises à des stress exogènes ou endogènes qui compromettent la stabilité du génome, conduisant à de l'inflammation, du vieillissement prématuré ou au cancer. Pour contrecarrer ces stress, la réponse aux dommages à l'ADN (DDR : DNA damage response) met en jeu un réseau de voies métaboliques coordonnant le cycle cellulaire, la réplication et la réparation de l’ADN. Ainsi la suite à un stress génotoxique, l'activation de la DDR entraîne l'arrêt de la progression du cycle cellulaire et de la réplication du génome. Ceci laisse à la fois suffisamment de temps et une accessibilité totale aux cofacteurs essentiels (ATP et nucléotides) à la machinerie de réparation de l'ADN. Cette réponse coordonnée permet aux cellules survivantes de reprendre la réplication sur une matrice d'ADN intacte. Cependant, même en l'absence de stress exogène, les cellules sont régulièrement soumises à des stress endogènes inévitables, tels que le stress réplicatif et le stress oxydatif, qui mettent aussi en péril l'intégrité du génome. Malgré une exposition continue à ces stress endogènes chroniques, les cellules continuent à proliférer et à répliquer leur génome, ce qui suggère que la DDR n'est pas, ou seulement partiellement activée. Ceci soulève la question de savoir si les cellules répondent réellement aux stress de faible intensité (correspondant aux stress endogènes) ou si elles ont développé une ou plusieurs réponses alternatives spécifiques.
Les scientifiques montrent ici que les cellules humaines primaires répondent au stress réplicatif en deux phases distinctes, adaptant la réponse à la sévérité du stress. Après un stress réplicatif de faible intensité, qui ne conduit pas à l’activation de la DDR canonique et à un arrêt complet de la réplication, les cellules produisent des ROS (reactive oxygen species). Ces ROS induites par le stress réplicatif (RIR : Replication stress Induced ROS) sont synthétisées par les enzymes cellulaires de la famille des NADPH oxydases DUOX1 et DUOX2, dont l’expression est induite par le facteur de transcription NF-κB, qui est activé par la protéine de détection des dommages à l’ADN PARP1. Paradoxalement, cette production de RIR prévient l'accumulation de lésions oxydatives pré-mutagènes dans l'ADN. En effet, en plus d’être étroitement contrôlées par la cellule, les RIR sont exclues du noyau, et activent la voie de détoxification générale des ROS FOXO1 qui induit l’expression des gènes de détoxification, tels que SEPP1, la catalase, GPX1 et SOD2. Cette réponse protège également les cellules d'une exposition exogène au peroxyde d'hydrogène (eau oxygénée), définissant une réponse de type adaptatif. Chez les patients atteints de leucémie myélomonocytaire chronique, un traitement par l'hydroxyurée, qui génère un stress réplicatif, active les voies NF-κB et FOXO1 dans leurs cellules en prolifération, révélant l'activation de cette voie in vivo.
L'augmentation de l’intensité du stress de réplication induit la DDR canonique qui conduit à l’arrêt de la réplication de l'ADN et supprime les RIR d’une façon dépendante des protéines p53 et d’ATM. Cette étude met en évidence que la réponse cellulaire au stress réplicatif peut être subdivisée en deux phases :
- Une DDR de faible niveau de stress (LoL-DDR : Low-Level DDR), qui est adaptative, protégeant contre l'accumulation de lésions pré-mutagènes, mais qui n’arrête pas la réplication de l’ADN ;
- Une DDR de haut niveau de stress, qui arrête la réplication, contrôle le cycle cellulaire et la réparation de l’ADN (DDR canonique) et détoxifie les RIR.
En parallèle, l’activation de l’axe PARP1/ NF-κB par le stress réplicatif induit l’expression de cytokines inflammatoires qui pourraient activer la réponse immunitaire innée, permettant l’élimination des cellules porteuses de dommages à l’ADN. Cependant une activation chronique pourrait conduire à de l’inflammation.
Cette étude révèle une réponse de défense cellulaire spécifique à un stress de faible intensité, jamais décrite jusque-là, et soulignent la précision des réponses cellulaires en fonction de la sévérité du stress.
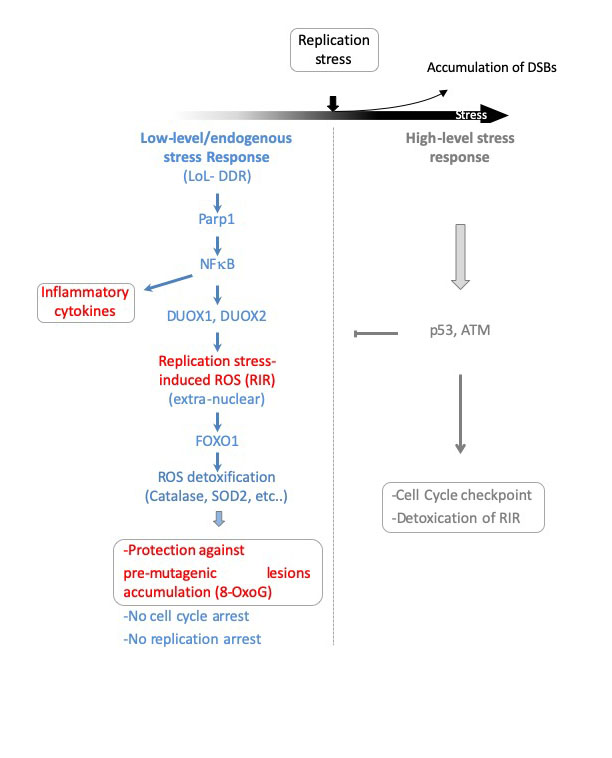
Figure : Le modèle de réponse bi-phasique aux dommages de l'ADN. Les cellules humaines primaires adaptent leur réponse à l'intensité du stress de réplication selon des phases distinctes : la réponse de bas niveau/stress endogène et la réponse de haut niveau. En dessous d'un certain seuil d'intensité de stress, les cellules engagent la réponse de bas niveau (LoL-DDR), qui ne réprime pas la synthèse de l'ADN et la progression cellulaire. La réponse LoL-DDR régule la production de « good » ROS extranucléaires (RIR) sous le contrôle de PARP1, NF-κB, DUOX1 et DUOX2. En parallèle, NF-κB induit l'expression de gènes de cytokines inflammatoires. Les RIR induisent le programme de détoxification FOXO1, protégeant contre l'accumulation de lésions pré-mutagènes, comme le 8-oxoG (8-oxo-Guanine), dans une réponse de détoxification de type adaptatif. Au-delà du seuil de stress, les cellules accumulent les cassures double brin de l’ADN et activent le DDR canonique, qui détoxifie le RIR par p53 et ATM.
Pour en savoir plus :
A noncanonical response to replication stress protects genome stability through ROS production, in an adaptive manner.
Sandrine Ragu, Nathalie Droin, Gabriel Matos-Rodrigues, Aurélia Barascu, Sylvain Caillat, Gabriella Zarkovic, Capucine Siberchicot, Elodie Dardillac, Camille Gelot, Josée Guirouilh-Barbat, J. Pablo Radicella, Alexander A. Ishchenko, Jean-Luc Ravanat, Eric Solary and Bernard S. Lopez*.
Cell Death & Differenciation, 3 mars 2023, DOI : https://doi.org/10.1038/s41418-023-01141-0
Contact
Laboratoire
Institut Cochin (Université Paris Cité/Inserm/CNRS)
22 rue Méchain
75014 Paris