Evolution dirigée du chaperon SecB vers les systèmes Toxine-Antitoxine
Certains systèmes toxine-antitoxine facilitent l’adaptation au stress ainsi que l’établissement de phénomènes de persistance et de tolérance aux antibiotiques chez les bactéries. Des chercheurs du laboratoire de Microbiologie et génétique moléculaires au Centre de biologie intégrative et de l’Institut de pharmacologie et de biologie structurale, ont montré pour la première fois comment un chaperon, généralement impliqué dans la sécrétion de protéines, pouvait rapidement évoluer afin de contrôler l’activation de certains systèmes toxine-antitoxine, comme c’est le cas chez le pathogène humain Mycobacterium tuberculosis. Ces travaux ont été publiés le 7 novembre 2017 dans la revue PNAS.
Les systèmes toxine-antitoxine (TA) sont des éléments génétiques qui modulent la croissance bactérienne en réponse à certains stress. Leur importance dans le phénomène de persistance bactérienne et dans la virulence de plusieurs pathogènes majeurs en fait des cibles thérapeutiques prometteuses. Les systèmes TAC (Toxine-Antitoxine-Chaperonne) sont des systèmes TA atypiques contrôlés par un troisième partenaire : un chaperon moléculaire qui assiste le repliement et prévient la dégradation de l’antitoxine, contrôlant ainsi indirectement l’activation de la toxine. De façon remarquable, les chaperons de TAC appartiennent à la famille des chaperons SecB, connus pour leur rôle dans l’export des protéines, et représentent donc un lien potentiel entre l’activation des toxines et l’export.
Les chercheurs ont examiné la spécialisation d’un chaperon moléculaire vers le contrôle d’un système TA en recréant ce phénomène en laboratoire par le biais d’une expérience d’évolution dirigée. Pour cela, ils ont utilisé comme point de départ le chaperon d’export SecB de la bactérie Escherichia coli et le système TAC le mieux caractérisé à ce jour, appartenant au pathogène Mycobacterium tuberculosis.
Cette approche a permis d’identifier et caractériser des mutations uniques qui améliorent la capacité de ce chaperon générique à contrôler spécifiquement le couple TA du système TAC de M. tuberculosis, sans affecter sa fonction naturelle dans l’export protéique. Cela démontre que des changements de séquence subtils dans SecB peuvent modeler l’interaction de ce chaperon avec des antitoxines sans impacter l’interaction avec ses substrats d’export (voir Figure), comme observé dans la grande diversité des systèmes TAC.
L’adaptabilité unique de SecB vis à vis de ses substrats observée dans ces travaux suggère que ce chaperon pourrait facilement être manipulé pour interagir avec de nouveaux substrats, comme par exemple des protéines instables associées à des maladies neurodégénératives ou d’autres protéines hétérologues pour des applications en biotechnologies.
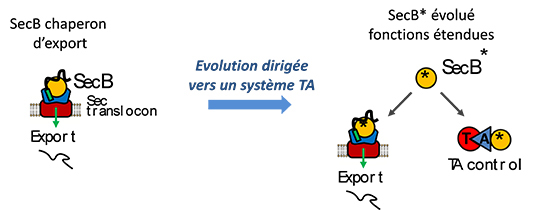
© Pierre Genevaux
En savoir plus
-
Directed evolution of SecB chaperones toward toxin-antitoxin systems.
PNAS 2017 ; published ahead of print November 7, 2017, doi:10.1073/pnas.1710456114
Ambre Julie Sala, Patricia Bordes, Sara Ayala, Nawel Slama, Samuel Tranier, Michèle Coddeville, Anne-Marie Cirinesi, Marie-Pierre Castanié-Cornet, Lionel Mourey, and Pierre Genevaux