Entre les murs – Bornes et modules mémoires des sites régulateurs de la transcription
Les promoteurs et enhancers qui régulent l’expression des gènes sont des espaces agrégeant facteurs de transcription, modifications épigénétique et ARN polymerase II. Cette étude, publiée dans la revue Nucleic Acids Research, montre que ces espaces sont clairement délimités de part et d’autre par des éléments génétiques mobiles, qui, par leur propension à être méthylés, limitent la propagation des marques épigénétiques activatrices. En parallèle, la capacité de ces éléments à positionner les nucléosomes fonctionne comme un mécanisme de mémoire particulièrement utilisé par les gènes de l’immunité.
Comment les régions régulatrices sont-elles positionnées sur le génome ? La question se pose clairement pour les séquences activatrices (ou enhancers) qui sont souvent localisées à distance des gènes qu’elles régulent, parfois à plusieurs centaines de milliers de bases. Pour les promoteurs, la question se pose également puisque la transcription est toujours initiée largement en amont des régions codant pour des protéines.
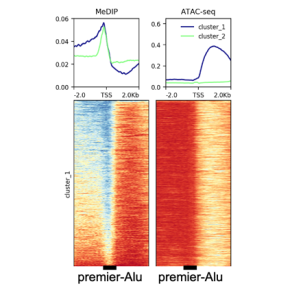
Les scientifiques ont exploré la possible implication des éléments génétiques mobiles de la famille des "Alu" (présents à environ 1 million de copies, soit 10% du génome humain) dans le positionnement de plusieurs marques épigénétiques liées à l’activation et à la répression de la transcription. Cette étude montre que, lorsqu’une région régulatrice est active, le premier Alu en amont du site d’initiation de la transcription (TSS) constitue la limite où se termine la méthylation de l’ADN qui entoure le gène et où commence la région non-méthylée formant le promoteur ou l’enhancer. La méthylation de l’ADN de l’Alu fonctionne ainsi comme une barrière à la propagation de la marque d’activation H3K4me3 (trimethylation de la Lysine4 de l'histone H3).
Par ailleurs, lorsque la distance entre le premier Alu amont et le TSS est courte, cet Alu accumule du signal H3K4me1 (mono-methylation de la même Lysine4) de manière particulièrement stable lorsque le gène est activé. Ce signal H3K4me1 positionné sur l’Alu semble ainsi correspondre à une mémoire des phases d’activité du gène. Or, l’observation des intervalles Alu-TSS dans les promoteurs et enhancers actifs de 127 tissus différents, montre que cet intervalle est plus long pour les régions régulatrices des cellules souches et spécialement court pour celles des lymphocytes T. Les lymphocytes T et particulièrement les gènes de l’immunité actifs dans ces cellules font donc abondamment appel au système de mémoire fournit par le positionnement de nucléosomes marqués H3K4me1.
Ces résultats apportent ainsi plusieurs éléments nouveaux sur le positionnement des régions régulatrices, mais aussi sur l’épigénétique de l’immunité. Ils révèlent que les séquences Alu constituent les bornes des régions régulatrices, mais aussi que le positionnement de nucléosomes marqués H3K4me1 sur ces bornes peut fonctionner comme un mécanisme de mémoire. Étonnamment, ce mécanisme est particulièrement utilisé par les gènes de l’immunité, alors qu’il est contre-sélectionné pour les gènes du développement. Il reflète ainsi la nécessité de « l’oubli » chez la cellule pluripotente, et le bénéfice de l'entraînement pour l'immunité. Les scientifiques suggèrent que le positionnement du signal H3K4me1 pourrait constituer un mécanisme permettant « d’entrainer » les gènes de l’immunité pour une réponse rapide à l’occasion d’une deuxième attaque d’un même pathogène.
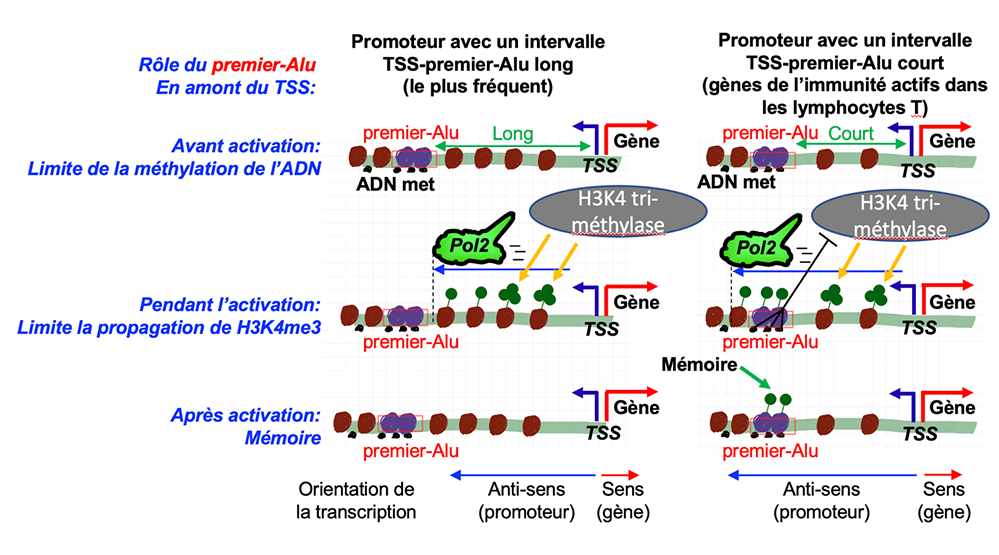
Figure : (Panel de gauche) Les promoteurs sont des régions dépourvues de séquences Alu et le premier Alu amont est généralement suffisamment loin du TSS pour ne pas être atteint par la transcription qui parcourt les régions régulatrices. (Panel de droite) Cette règle n’est cependant pas respectée pour de nombreux gènes de l’immunité. Pour ces gènes, le premier Alu amont étant proche du TSS, il est transcrit par l’ARN polymérase II, entrainant le dépôt de marques H3K4me1. Cette mono méthylation en H3K4 ne progresse cependant pas vers une tri-méthylation à de cause de la méthylation de l’ADN de l’Alu. Après la phase d’activation, les nucléosomes portant la marque H3K4me1, stablement positionnés sur le premier Alu, gardent une mémoire de la phase d’activité.
Pour en savoir plus :
The 'Alu-ome' shapes the epigenetic environment of regulatory elements controlling cellular defense.
Costallat M, Batsché E, Rachez C, Muchardt C.
Nucleic Acids Res. 20 mai 2022. https://doi.org/10.1093/nar/gkac346
Contact
laboratoire
Biological Adaptation and Ageing-Institut de Biologie Paris-Seine (CNRS/Sorbonne Université)
7-9, Quai Saint Bernard
75252 Paris Cedex 05