Du virus SARS-CoV2 caché dans les plaquettes sanguines prédit l’entrée en phase critique de COVID-19
Dans une étude parue dans la revue Cellular and Molecular Life Science, les scientifiques montrent que la présence du virus SARS-CoV-2 infectieux dans les plaquettes est un marqueur sanguin prédictif d’une forme de COVID-19 critique. Les plaquettes sont alors capables de transférer l’infection aux cellules de l’immunité innée. Ce processus peut être bloqué par un médicament anti-plaquettaire utilisé en cardiologie : l’Abciximab.
Malgré la vaccination et le développement des traitements symptomatiques environ 5 à 10 % des personnes atteintes de Covid-19 évoluent vers une forme grave ou critique. Ces patients développent surtout une pneumonie sévère qui évolue en syndrome de détresse respiratoire aiguë accompagné de la propagation du virus des voies respiratoires vers d'autres sites, ciblant les cellules de l’immunité innée comme les macrophages. L’aggravation respiratoire se produit en général durant la seconde semaine après l’apparition des premiers symptômes. Elle coïncide avec des troubles de la coagulation dont des épisodes de micro-agrégation de plaquettes mal comprises, notamment au niveau des poumons, même chez les personnes sans antécédent de maladie cardio-vasculaire. Cependant, le traitement anticoagulant des patients COVID-19 est d'une efficacité limitée.
A leur rôle essentiel dans l’hémostase, les plaquettes associent des fonctions immunologiques bien établies contribuant à l'inflammation et peuvent dans certaines pathologies virales, héberger et transporter des virus. De plus, des études récentes ont montré que les mégacaryocytes, les cellules précurseurs des plaquettes, sont capables de migrer de la moelle osseuse où ils prennent naissance, vers les poumons où ils produisent localement des plaquettes. Celles-ci finissent leur courte vie capturées par les cellules de l‘l’immunité innée (macrophages) qu’elles activent. Les plaquettes pourraient donc être impliquées dans la physiopathologie des COVID sévères à plusieurs titres : dans la genèse des troubles de l’hémostase (thromboses) ; en favorisant la dissémination virale lors de leur circulation ubiquitaire ; enfin dans « l’orage cytokinique » déclenché par les macrophages qu’elles auront activés.
Comment prédire qu’un patient atteint du COVID-19 risque une issue fatale ? Pour répondre à cette question déterminante dans la prise en charge individuelle et le pronostic des patients, les scientifiques ont fait l’hypothèse que les plaquettes, issues de mégacaryocytes infectées par SARS-CoV-2 dans la moelle ou les poumons, pourraient être porteuses de virus contribuant aux troubles de l’hémostase et la dissémination virale observés dans le COVID-19 et pourraient contribuer au développement critique de la maladie. En effet, chez les patients gravement malades, les chercheurs ont pu montrer que dans les tissus d’autopsies, les mégacaryocytes de la moelle et des capillaires pulmonaires étaient infectés. Ces mégacaryocytes infectés sont capables de produire des plaquettes infectées qui atteignent les poumons où, en interagissant avec les macrophages pulmonaires, elles déclenchent un orage cytokinique riche en facteurs affectant l’intégrité des vaisseaux et en molécules inflammatoires.
La détection de ces plaquettes infectées dans les sang des patients atteints de COVID-19 sévère dans les deux premières semaines après l’apparition des premiers symptômes, est un marqueur prédictif de l’issue fatale chez la quasi-totalité des patients (dans 19 cas sur 20 analysés). De plus, les virus contenus dans les plaquettes gardent leur caractère infectieux. Une fois capturées par les macrophages, les plaquettes infectées leur transmettent l’infection in vitro selon un processus qui est bloqué en ciblant la protéine GPIIbIIIa à la surface de la plaquette par l’agent antiagrégant plaquettaire Abciximab.
Les scientifiques soulignent le rôle immunologique des plaquettes et leur implication majeure dans la COVID-19 sévère à trois niveaux : i) tout d’abord dans les troubles de l’hémostase avec la formation du thrombus (caillot obturant les vaisseaux), ii) dans la dissémination virale où les plaquettes sont un cheval de Troie pour le virus infectieux, le protégeant de sa destruction par le système immunitaire et iii) la tempête exacerbée de cytokines. Ces effets néfastes pourraient être ciblés cliniquement en une seule fois à l'aide de médicaments anti-plaquettaires spécifiques, ce qui augmenterait les chances de survie des patients. Les résultats des chercheurs permettent également de prédire le pronostic fatal suffisamment tôt afin d'anticiper une conduite médicale appropriée.
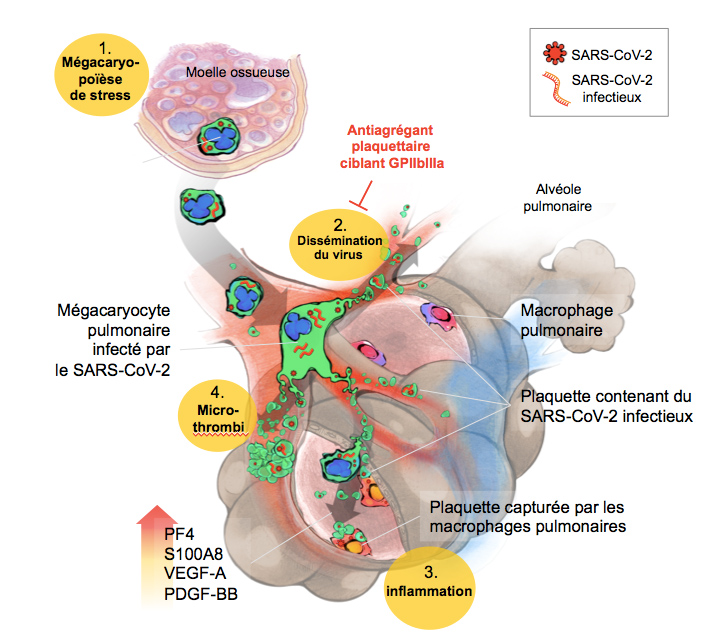
Figure : Les plaquettes infectées par le SARS-CoV-2 sont une cible thérapeutique vers laquelle convergent les multiples manifestations cliniques du COVID-19 critique
1- Dans la moelle, le SARS-CoV-2 infecte les mégacaryocytes et accélère leur différentiation. Ceux-ci migrent vers les poumons où ils produisent des plaquettes contenant du virus dans la circulation pulmonaire. 2- Ces plaquettes infectieuses disséminent le virus vers d’autres sites en infectant les cellules de l’immunité innée. 3- Les plaquettes hyperactivées contribuent à l’inflammation systémique et à la formation de thrombus observée dans les complications de COVID-19 sévère. 4- L’orage cytokinique enrichi en molécules inflammatoires et en cytokines affectant l’intégrité de la surface des vaisseaux et des alvéoles pulmonaires, permet aux plaquettes de pénétrer le tissu pulmonaire et d’infecter les macrophages alvéolaires.
Pour en savoir plus :
Infection of lung megakaryocytes and platelets by SARS-CoV-2 anticipate fatal COVID-19
Zhu A, Real R; Capron C, Rosenberg A, Zhu J, Cottignies-Calamarte A, Massé JM, Moine P, Bessis S, Godement M, Geri G, Chiche JD, Valdebenito S, Belouzard S, Dubuisson J Lorin de la Grandmaison G, Eugenin E, Chevret S, Annane D, Cramer-Bordé E, Bomsel M.
Cell Mol Life Sciences 16 juin 2022. https://doi.org/10.1007/s00018-022-04318-x
Contact
Laboratoire
Entrée muqueuse du VIH et immunité muqueuse (Institut Cochin/CNRS/Inserm/Université de Paris Cité)
22 rue Méchain
75014 Paris