DolP entre le « Yin et le Yang » de la réponse au stress chez les entérobactéries
Pour faire face aux agressions qu’elles rencontrent dans leur environnement, les entérobactéries développent des réponses adaptatives leur permettant de maintenir leur enveloppe protectrice imperméable et fonctionnelle. Dans cet article publié dans la revue eLife, les scientifiques montrent que, chez la bactérie modèle Escherichia coli, la protéine DolP, via un mécanisme de réponse finement coordonné, permet aux cellules de compenser un effet délétère de la réponse au stress qui pourrait compromettre l’intégrité de l’enveloppe.
Les entérobactéries, bacilles Gram négatifs présents essentiellement dans la flore intestinale des mammifères, sont dotées d’une enveloppe imperméable qui leur permet de mieux résister à des agents toxiques, tels que les antibiotiques ou des détergents. Pour assurer leur survie dans ces environnements hostiles, les bactéries doivent en permanence préserver l’intégrité de cette enveloppe, en particulier de la membrane externe (ME) composée d’acides gras et de protéines jouant un rôle crucial. Ainsi, les protéines intégrales de l’enveloppe, dites Outer Membrane Proteins (OMPs) assurent diverses fonctions critiques pour la croissance bactérienne, la défense ou encore la pathogénicité. En cas de défaut de ces OMPs, la barrière de perméabilité des bactéries est altérée et une voie transcriptionnelle de réponse au stress, notée sE, est déclenchée.
Une des réponses de cette voie est la surproduction de la machinerie BAM (b-barrel assembly machinery) responsable de l’assemblage des protéines intégrales de l’enveloppe dans la membrane externe, permettant de rétablir leur fonction. Les scientifiques ont découvert qu’une accumulation de BAM chez Escherichia coli pouvait être toxique pour la cellule, suggérant un mécanisme finement régulé. Afin de décrypter les bases moléculaires de l’équilibre entre « le Yin et le Yang » de la réponse au stress, ils ont mis en lumière le rôle déterminant de DolP, une lipoprotéine de la ME induite par la réponse sE, dans ce processus en montrant que DolP entre en contact avec le complexe BAM au niveau de la ME. En interagissant directement avec BamA, la sous-unité centrale de BAM, DolP permet le repliement correct de cette protéine membranaire, altéré lors de sa surproduction. Ainsi, DolP assure la pleine fonctionnalité de BAM requise au maintien de l’intégrité de l’enveloppe. De plus, les chercheurs montrent qu’en condition de stress, DolP perd sa localisation à la zone de division cellulaire (septum) où elle est supposée réguler le remodelage du peptidoglycane, composant la paroi des bactéries. Ceci suggère un lien entre le stress de l'enveloppe causé par une altération de la biogenèse des OMPs et la régulation d'une étape tardive de la division cellulaire.
En apportant des éléments nouveaux sur les mécanismes de biogénèse et de maintenance de l’enveloppe des bactéries Gram négatives, ces travaux pourraient permettre d’identifier de nouvelles cibles d’intérêt pour le développement d’antibiotiques innovants.
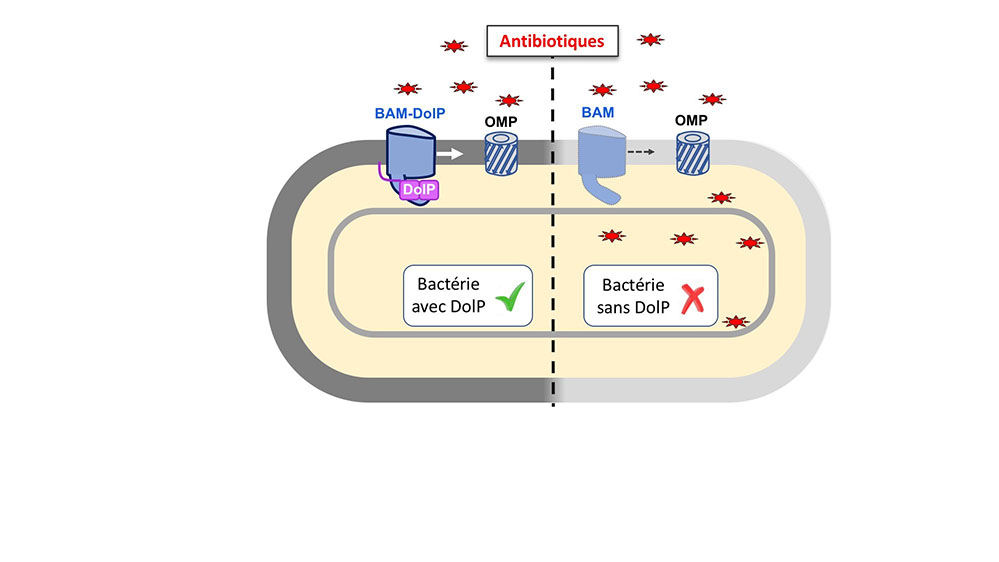
Figure : Les entérobactéries, entourées d’une membrane externe formant une barrière de perméabilité, sont particulièrement aptes à survivre en présence d'antibiotiques et de détergents. Le complexe BAM, en permettant l’assemblage des protéines intégrales de la membrane externe (OMPs), est essentiel pour la biogénèse de la membrane externe. DolP favorise le repliement et la fonction du complexe BAM, assurant une intégrité optimale de la membrane externe pour faire face aux antibiotiques.
Pour en savoir plus :
Lipoprotein DolP supports proper folding of BamA in the bacterial outer membrane promoting fitness upon envelope stress.
Ranava D, Yang Y, Orenday-Tapia L, Rousset F, Turlan C, Morales V, Cui L, Moulin C, Froment C, Munoz G, Rech J, Marcoux J, Caumont-Sarcos A, Albenne C, Bikard D, Ieva R.
Elife. 2021 Apr 13. doi: 10.7554/eLife.67817.
Contact
laboratoire
Laboratoire de microbiologie et de génétique moléculaires -LMGM (CNRS/université P Sabatier)
118 Route de Narbonne
31062 TOULOUSE CEDEX 9
Institut de pharmacologie et biologie structurale (IPBS)
BP 64182
205 route de Narbonne
31077 Toulouse Cedex 04
