Détection avant destruction : un laser ultra rapide pour capturer un radical insaisissable
Les enzymes sont impliquées dans des processus biologiques essentiels mais leur fragilité est un obstacle à l’obtention de leurs structures intactes par des méthodes conventionnelles de biologie structurale. Dans un article paru dans Science, la cristallographie en série couplée à un laser ultra rapide a permis d’observer pour la première fois la structure atomique de l’état radicalaire, un état extrêmement réactif, d’une enzyme, la ribonucléotide réductase de mycoplasme. Ce résultat, qui permet une compréhension inédite de la structure d'une enzyme, ouvre la voie à de potentielles innovations thérapeutiques.
Les radicaux libres ont mauvaise presse car ils peuvent endommager les cellules et ainsi participer au vieillissement. Cependant, les radicaux sont également essentiels à de nombreuses voies métaboliques centrales à la vie, telles que la synthèse des blocs de construction de l’ADN (les désoxyribonucléotides) qui est réalisée par l’enzyme ribonucléotide réductase. Cette dernière génère au sein de son architecture, un radical qui est indispensable à son fonctionnement. Parce qu’elle est présente chez l’être humain mais aussi chez de nombreux agents pathogènes tels que les mycoplasmes, elle est une cible médicamenteuse contre le cancer et une cible potentielle pour combattre les maladies infectieuses. Depuis sa découverte, le radical de la ribonucléotide réductase a été largement étudié. Cependant, la structure atomique d’un radical protéique restait inaccessible en raison de sa sensibilité face aux dommages causés par les techniques traditionnelles de biologie structurale, telles que la cryomicroscopie électronique et la cristallographie aux rayons X.
Un laser ultra rapide où chaque impulsion dure quelques femtosecondes
Les scientifiques ont donc relevé ce défi grâce au concept de « diffraction avant destruction », en illuminant un flot constant de cristaux de protéine avec un laser ultra rapide où chaque impulsion dure quelques femtosecondes (une femtoseconde est à une seconde ce qu’une seconde est à 32 millions d’années). Cette approche de cristallographie femtoseconde en série avec un laser à rayons X à électrons libres (XFEL en anglais) permet ainsi de collecter des données structurales avant même que tout dommage n’ait pu survenir à l’échantillon. Ici, la structure atomique de la ribonucléotide réductase de mycoplasme a été déterminée dans son état radicalaire, c’est-à-dire stockant un radical intact en son cœur.
La structure d’un radical protéique accessible pour la première fois !
Cette structure de l'état radicalaire de l’enzyme ribonucléotide réductase révèle des caractéristiques structurelles frappantes, telles qu’une liaison hydrogène remarquablement courte et un réarrangement critique des acides aminés et molécules d’eau bordant le site d'acquisition du radical. Les informations détaillées de la structure fournissent une base solide pour décortiquer le processus de mobilisation du radical au sein de l’enzyme qui n'est pas une fin en soi, mais plutôt le prélude à une étape encore plus importante. En l'occurrence, elle prépare le terrain pour la synthèse des blocs de construction de l'ADN. Ces résultats apportent une pièce manquante au puzzle des ribonucléotide réductases et représentent une avancée majeure pour la compréhension de la biochimie des radicaux. Enfin, ces travaux démontrent pour la première fois qu’il est possible de capturer la structure d’un radical protéique jusqu’alors inaccessible.
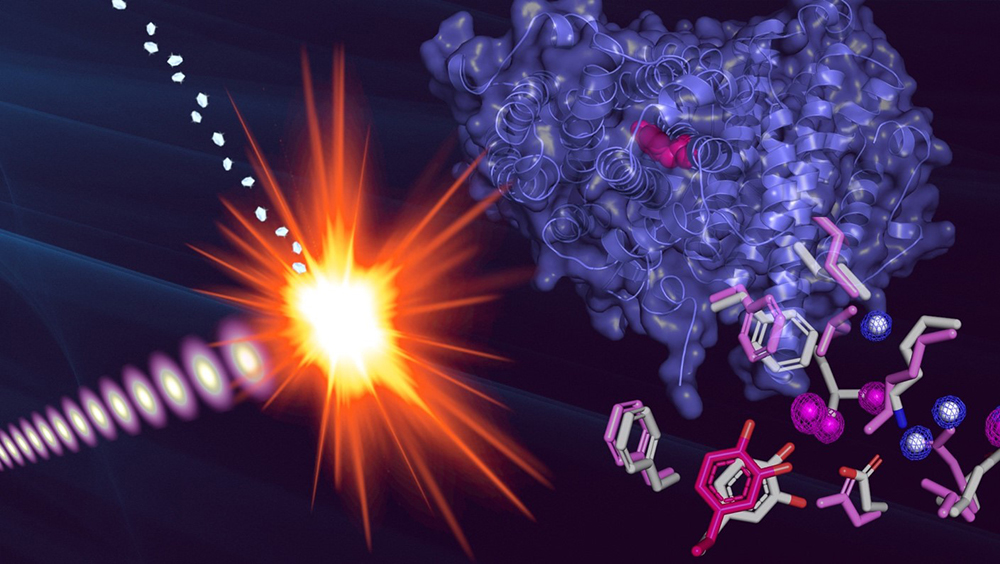
Figure : Structure de la sous-unité R2 de la ribonucléotide réductase de mycoplasme obtenue par cristallographie femtoseconde en série par laser à rayons X à électrons libres. La superposition des acides aminés entre les deux états, radicalaire (rose) et non-radicalaire (gris), montre les changements conformationnels induits par l’acquisition du radical.
En savoir plus :
Hugo Lebrette et al. Structure of a ribonucleotide reductase R2 protein radical.Science382,109-113(2023).DOI:10.1126/science.adh8160
Contact
Laboratoire
Laboratoire de microbiologie et de génétique moléculaires - LMGM (CNRS/Université Toulouse Paul Sabatier)
169 Avenue Marianne Grunberg-Manago,
31062 Toulouse, France