Des ressorts fluorescents pour mesurer un gradient de force dans les protéines
Parvenir à insérer des ressorts fluorescents microscopiques parmi les chaînons d’une protéine, mesurer simultanément, dans des cellules vivantes, les forces mécaniques infimes s’exerçant sur deux types de ces ressorts et mettre ainsi en évidence un subtil gradient de forces au sein même de la protéine: c’est le résultat qu’ont obtenu des chercheurs de l’Institut de génétique et développement de Rennes, en collaboration avec une équipe de l'Institut Max Planck de biochimie (Allemagne) en utilisant une nouvelle méthode d'imagerie. Cette étude a été publiée le 18 septembre 2017 dans la revue Nature Methods.
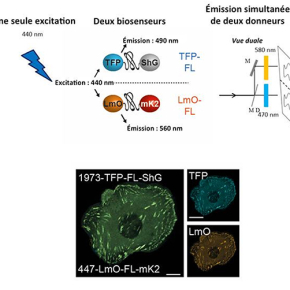
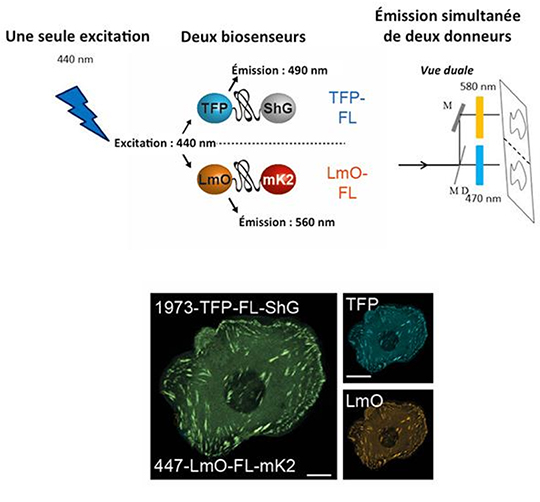
L’adaptabilité des domaines d’adhésion des cellules à leur matrice extracellulaire permet à la cellule de ressentir des rigidités de la matrice et d’induire des forces externes, mécanismes cellulaires essentiels impliqués par exemple dans la migration cellulaire. Pour comprendre les mécanismes moléculaires mis en jeu, les chercheurs ont développé une sorte de petit ressort fluorescent qui sonde la tension à travers les protéines. Ce ressort est constitué d’un peptide élastique entouré de deux protéines fluorescentes qui jouent le rôle de donneur et d’accepteur de FRET (transfert d’énergie non radiatif entre fluorophores). En mesurant l’efficacité de FRET qui dépend de la distance entre donneur et accepteur, on peut mesurer la tension appliquée à la protéine d’intérêt.
La taline est une protéine concentrée dans les domaines d’adhésion des cellules. Elle fait le lien entre les intégrines, protéines traversant la membrane cellulaire pour interagir avec la matrice, et les filaments d’actine qui constituent la structure contractile interne de la cellule. C’est une longue protéine constituée de plusieurs domaines de liaison à l’actine. En insérant des petits ressorts fluorescents de différentes rigidités à différents endroits de la protéine et en exprimant cette protéine chimérique dans des cellules adhérentes en culture, l’équipe de Carsten Grashoff à l'Institut Max Planck de Biochimie, a voulu savoir si les forces mécaniques appliquées aux différents domaines de la taline étaient constantes. Pour répondre à cette question, il a été nécessaire de mesurer les forces sur les différents ressorts simultanément dans une même cellule. L’équipe de Marc Tramier avait préalablement développé une méthode de mesure multiplex du FRET (Déméautis et al., Scientific Reports, 2017), la même mesure qui permet de caractériser la force dans les ressorts fluorescents. En adaptant cette approche à la taline, les expériences effectuées sur la plateforme de microscopie de Rennes MRic ont permis de démontrer qu’il existait un gradient de force au sein même de la protéine, la tension mesurée n’étant pas identique dans les différents domaines.
Cette étude représente une avancée importante, car les forces associées aux différents domaines d’une protéine n’étaient pas directement accessibles auparavant. Les résultats obtenus permettent d’analyser sous un jour nouveau les rôles respectifs des différents domaines d’interaction de la taline avec le cytosquelette d’actine. La méthodologie développée doit pouvoir s’adapter à la compréhension du rôle et du mécanisme d'action d’autres protéines impliquées dans la mécanique cellulaire.
© Marc Tramier
En savoir plus
-
Multiplexing molecular tension sensors reveals piconewton force gradient across talin-1.
Ringer P, Weißl A, Cost AL, Freikamp A, Sabass B, Mehlich A, Tramier M, Rief M, Grashoff C.
Nat Methods. 2017 Sep 18. doi: 10.1038/nmeth.4431