Des photons explorateurs de l’activité neuronale
Mesurer l’activité neuronale dans le cerveau des rongeurs par des techniques de microscopie plutôt que par des méthodes d’électrophysiologie offre de nombreux avantages. Une limitation majeure des approches optiques réside néanmoins dans leur résolution temporelle insuffisante. Les scientifiques ont mis au point une nouvelle approche d’imagerie combinant la microscopie non-linéaire à deux photons et l’holographie pour enregistrer l’activité individuelle de larges populations neuronales avec une résolution temporelle compatible avec l’échelle de temps du traitement de l’information dans le cortex. Ces résultats sont publiés dans la revue Nature Methods.
Comprendre les mécanismes neuronaux sous-tendant la perception sensorielle, la prise de décision ou la commande d’actions motrices nécessite d’enregistrer l’activité de larges populations neuronales distribuées en trois dimensions dans le cerveau. L’approche classique consiste à implanter des électrodes dans la zone d’intérêt. Les méthodes optiques apparaissent aujourd’hui comme des alternatives puissantes : elles sont moins invasives, permettent d’effectuer des enregistrements chroniques des mêmes cellules ou encore d’avoir des informations génétiques sur les cellules enregistrées.
Les méthodes optiques reposent sur l’utilisation d’indicateurs fluorescents, tels que des sondes sensibles à la concentration intracellulaire de calcium, qui permettent une lecture de l'activité électrique des neurones. Pour pouvoir obtenir des images avec une résolution cellulaire en profondeur dans le cerveau, un tissu diffusant, il est nécessaire d’utiliser la microscopie de fluorescence à deux photons, ce qui limite fortement la fréquence d’acquisition des enregistrements, en particulier en 3D.
Les scientifiques ont développé la méthode CASH (Custom-Access Serial Holography) afin d'améliorer drastiquement la fréquence d’acquisition optique en 3D des indicateurs d'activité neuronale. La méthode CASH est basée sur l’idée d’abandonner l’enregistrement d’une image 2D ou d’une pile d’images en 3D et de n’enregistrer que l’activité des neurones d’intérêt, sans perdre de temps dans les régions entre les cellules. Les impulsions du laser sont envoyées successivement sur chaque neurone étudié, une impulsion par neurone. Chaque impulsion est structurée par holographie en une grille rectangulaire de points focaux répartis sur l'objet cible et son voisinage immédiat afin de maximiser le signal de fluorescence collecté et minimiser les artefacts de mouvement présents dans les enregistrements avec des animaux effectuant une tâche comportementale. La mise en œuvre de 3D-CASH nécessite donc une modulation spatiale du faisceau laser ultra-rapide pour offrir un contrôle complet de la phase du faisceau laser à chaque nouvelle impulsion.
La méthode permet typiquement l'enregistrement de l’activité de 20 neurones avec une fréquence d’acquisition de 1 000 Hz (c’est-à-dire que pour chaque cellule, une mesure est réalisée chaque milliseconde) ou de 200 neurones avec une fréquence d’acquisition de 100 Hz (une mesure toutes les 10ms) en 3D dans un volume de 500 x 500 x 500 µm. A titre de preuve de concept, les chercheurs ont enregistré l’activité des neurones des couches 2/3 et 5 du cortex visuel primaire de souris. Ils ont pu caractériser la sélectivité de chaque cellule à l’orientation et à la phase de stimuli visuels formés de barres de contrastes en mouvement et analyser la structure des corrélations temporelles d’activité de paires de cellules au sein et entre les différentes couches laminaires du cortex.
3D-CASH permet donc une fréquence d’acquisition élevée, sans précédent, pour l’enregistrement de l’activité neuronale en 3D in vivo. Or la résolution temporelle est un paramètre critique pour l'analyse des décharges neuronales et de leurs corrélations dans les réseaux, car l'échelle de temps pertinente pour l'intégration neuronale est de l’ordre de 10-15 ms dans les neurones pyramidaux du cortex. Aucune technique classique d’imagerie à deux photons ne permet d’accéder à cette échelle de temps, en particulier en 3D. 3D-CASH offre donc des perspectives uniques pour étudier l’organisation temporelle et spatiale de l’activité neuronale dans des animaux effectuant des tâches comportementales simples. La méthode est également très prometteuse pour les futurs enregistrements utilisant des sondes fluorescentes sensibles au potentiel de membrane -en plein développement-, car la cinétique intrinsèque de leur réponse à un potentiel d'action nécessite des fréquences d'acquisition de 500 Hz et plus, inaccessibles avec les approches classiques.
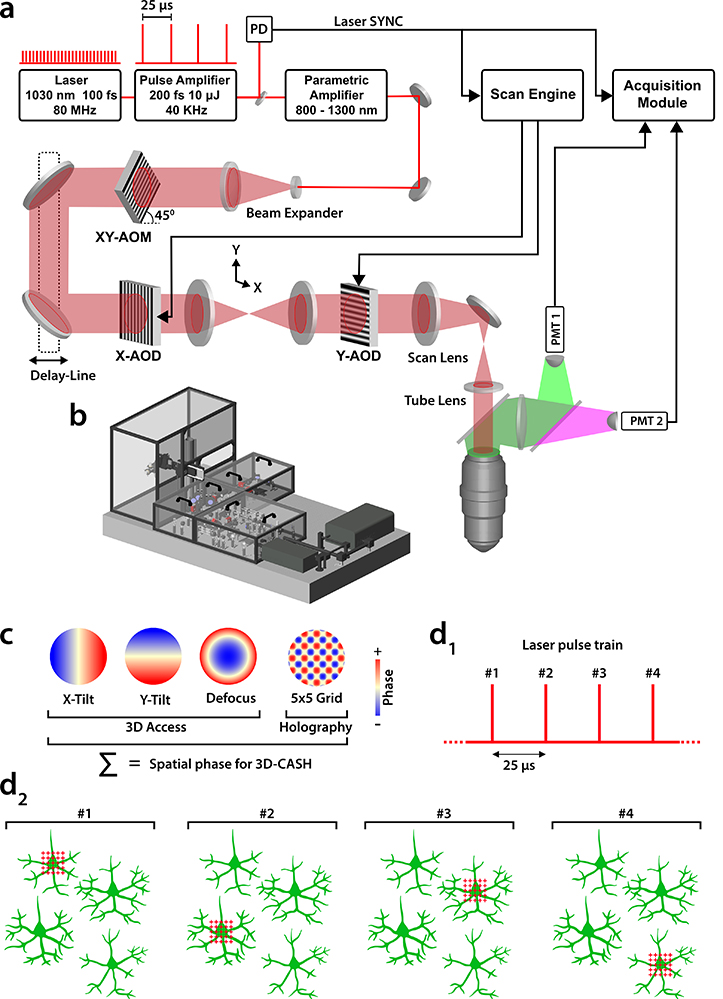
Figure : Modulation spatiale acousto-optique de la lumière pour l'holographie. a) Schéma du microscope à deux photons pour l'enregistrement CASH de l'activité neuronale. La modulation de phase et d'amplitude des impulsions laser femtosecondes est réalisée par deux déflecteurs acousto-optiques (AOD) synchronisés à l'horloge laser. b) Représentation 3D du microscope. c) Modes de phase utilisés. Pour l'accès en 3D aux cellules : inclinaison et défocalisation ; pour créer une grille dans le plan focal : modulation de phase holographique. d1-2) Protocole d'échantillonnage 3D- CASH de neurones situés à des positions arbitraires en 3D. Train d'impulsions laser (d1) ; chaque impulsion est dotée d’une phase spatiale propre pour accéder à un corps cellulaire différent (vert) avec une grille d'excitation 5x5 (rouge) couvrant le corps cellulaire et l'espace péri-somatique voisin (d2).
Pour en savoir plus :
Fast optical recording of neuronal activity by three-dimensional custom-access serial holography.
Akemann W, Wolf S, Villette V, Mathieu B, Tangara A, Fodor J, Ventalon C, Léger JF, Dieudonné S, Bourdieu L.
Nat Methods. 2022 Jan;19(1):100-110. doi: 10.1038/s41592-021-01329-7.
Contact
Laboratoire
Institut de biologie de l'Ecole normale supérieure - IBENS (CNRS/Inserm/Ecole normale supérieure)
46 rue d'Ulm
75005 Paris