Des lipides sont impliqués dans la détection et la réparation de l’ADN
Les dommages à l'ADN doivent être détectés et réparés avec précision afin de garantir le maintien de l'intégrité du génome d’une cellule et, par conséquent, de l’organisme entier. Si la contribution des protéines à l’accomplissement de cette tâche est bien connue, il n'en est pas de même pour celle des lipides, une autre famille de molécules essentielles à la vie. Un travail récent publié dans The EMBO Journal révèle comment deux types de lipides, les stérols et les phosphoinositides, contribuent à signaler la présence de dommages à l’ADN.
L'intégrité de l'information génétique contenue dans l’ADN doit être préservée pour garantir le fonctionnement de la cellule et de l'organisme. La cellule possède des stratégies de surveillance et de réparation pour accomplir cette tâche. Ainsi, les cellules ayant des dommages à l'ADN les détectent et activent une réponse afin d'arrêter la progression du cycle cellulaire et engager la réparation de l'ADN. La détection des lésions est effectuée par des protéines spécialisées, telle que la kinase ATM, capables de modifier d’autres protéines, initiant ainsi la mise en route d’une réponse en cascade. Il est également essentiel d’éteindre cette cascade de signalisation une fois les lésions réparées afin de permettre à la cellule de reprendre une activité normale.
Notre compréhension des événements permettant l’activation et la désactivation de cette réponse a été essentiellement construite sur l´étude de l’interaction entre les protéines et les acides nucléiques, tels que l’ARN et l’ADN. La majorité des événements ont lieu à l’intérieur du noyau de la cellule, où le matériel génétique est conservé. La possible contribution à la signalisation des dommages à l’ADN d’une autre famille de molécules essentielles à la vie, telle que les lipides, n’a pas été systématiquement explorée, bien que le noyau lui-même soit délimité par deux membranes lipidiques arrangées de manière concentrique autour du matériel génétique.
De manière intéressante, quelques observations publiées lors de ces dix dernières années ont rapporté une possible connexion entre le métabolisme des lipides et le devenir de l’ADN endommagé. Afin d’aborder cette question, les scientifiques ont évalué si la présence de dommages à l’ADN induisait des changements dans la distribution cellulaire des lipides. Ils ont constaté que la présence spécifique de cassures double-brin de l’ADN produisait une redistribution des lipides dans la membrane du réticulum endoplasmique (RE), l’organite où ont lieu le repliement conformationnel de multiples protéines, l’homéostasie du calcium et la synthèse de nombreux lipides. Ils ont observé que des molécules de stérol, des lipides présents dans le RE, étaient sélectivement stockées dans des gouttelettes lipidiques, un autre organite servant de réservoir. Ces stérols du RE, s’ils n’avaient pas été stockés, auraient activé un échangeur entre le RE et un troisième organite, le Golgi. Cette échangeur, appelé OSBP1, extrait une molécule de stérol du RE et l’insère dans la membrane du Golgi en échange d’une autre molécule lipidique: le phoshatidyl-inositol-4-phosphate (PI(4)P). La question était alors de comprendre si la sortie des stérols du RE vers les gouttelettes lipidiques en réponse aux cassures à l’ADN, ce qui modifie l’activité de OSBP1, avait une quelconque importance pendant la signalisation et la réparation des telles cassures.
En utilisant une approche multidisciplinaire, combinant la biochimie, la génétique et la microscopie à fluorescence, le travail publié dans The EMBO Journal décrit que l’activité de la protéine kinase ATM, agissant en amont dans la réponse aux cassures double-brin de l’ADN, est régulée par l’activité de l’échangeur OSBP1. Il a été montré qu’ATM est capable de lier les molécules de PI(4)P présentes dans le Golgi, ce qui, par conséquent, limite sa disponibilité à l’intérieur du noyau. Selon l’activité de l’échangeur OSBP1, la quantité de PI(4)P dans le Golgi peut être élevée, stabilisant la présence d’ATM au niveau du Golgi (donc loin de l’ADN) ; ou basse, permettant un relâchement d’ATM et de le rendre disponible à l’intérieur du noyau. Ainsi, à la suite de l’apparition de cassures double-brin de l’ADN, la présence initiale d’ATM dans le noyau permet de signaler de la présence de ces dommages. S’en suit le stockage des stérols dans les gouttelettes lipidiques, ce qui va faire baisser leur quantité dans le RE, ralentissant l’activité de l’échangeur OSBP1. En conséquence, le PI(4)P va être stabilisé au Golgi et attirera les molécules d’ATM présentes dans le noyau. Ceci va permettre l’extinction de la réponse aux dommages pour permettre la reprise d’une activité cellulaire normale après réparation.
Ce mécanisme a été découvert dans les cellules de la levure boulangère Saccharomyces cerevisiae, puissant modèle d’étude en biologie, mais aussi dans deux lignées de cellules humaines maintenues en culture, ce qui suggère une forte conservation du mécanisme au cours de l’évolution. Les implications de cette boucle de régulation d’ATM sont importantes, car la présence élevée des stérols dans le RE ne permet pas d’éteindre la réponse aux dommages à l’ADN, maintenant un arrêt du cycle cellulaire et affectant la vie de la cellule. Dans le cas des maladies dégénératives dont la cause est liée à l’accumulation de dommages à l’ADN, ceci pourrait être fatal, accélérant le processus de dégénérescence. En revanche, dans le cas des cancers, une augmentation du stockage de stérols dans les gouttelettes lipidiques réduirait l’activité d’OSBP1. En conséquence, la stabilisation du PI(4)P au Golgi réduirait la présence d’ATM dans le noyau, ce qui leur permettrait, soit d’ignorer le besoin d’arrêter le cycle cellulaire en réponse aux dommages à l’ADN, soit de désactiver la réponse prématurément. Dans les deux cas, cela faciliterait la prolifération incontrôlée des cellules cancéreuses.
Enfin, cette étude ouvre de nouvelles questions, dont la compréhension du mécanisme conduisant au stockage de stérols vers les gouttelettes lipidiques en réponse aux cassures double brin dans l’ADN, ou celui permettant leur déstockage afin de permettre aux cellules de réagir face à de nouvelles cassures de l’ADN.
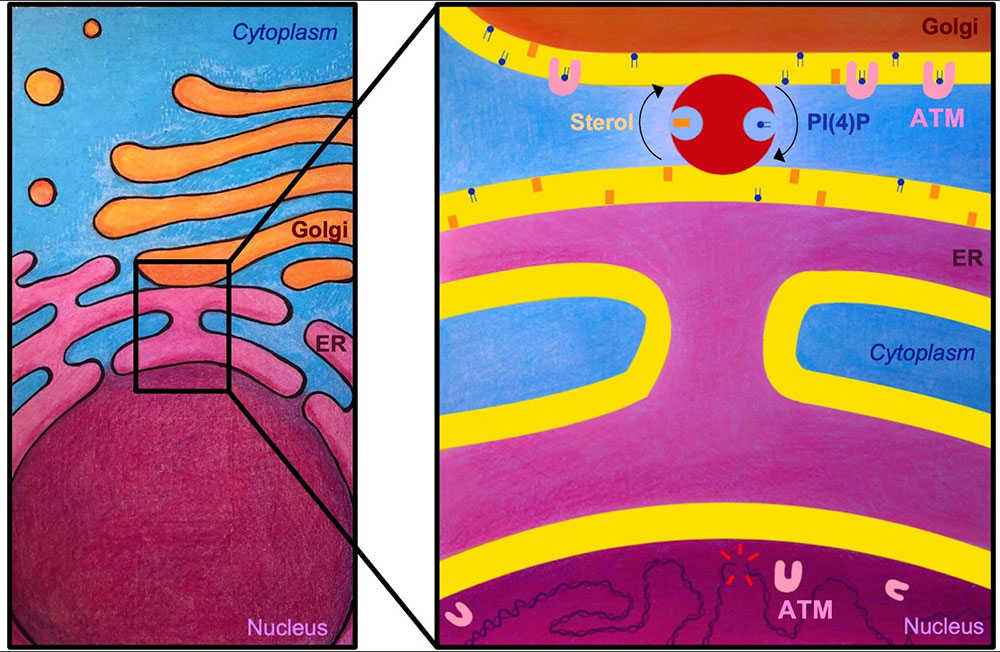
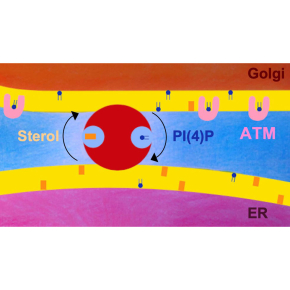
Figure : schéma global du noyau (en mauve), défini par deux membranes concentriques, dont la plus externe est un continuum avec celle du réticulum endoplasmique (RE, en rose). La membrane du RE établit de nombreux contacts avec celle du Golgi (en orange). À droite : zoom sur la partie indiquée du schéma précédent, montrant l’ADN cassé dans le noyau (traits rouges), dont la détection est assurée par la présence de la protéine kinase ATM. La disponibilité d’ATM dans le noyau est dictée par l’activité de l’échangeur OSBP1 (en rouge) qui échange des molécules de stérol du RE par de molécules de PI(4)P du Golgi. La liaison d’ATM avec le PI(4)P limite la présence d’ATM à l’intérieur du noyau lors de la signalisation des dommages à l’ADN.
En savoir plus :
Ovejero S., Kumanski S. Soulet C. et al. A sterol-PI(4)P exchanger modulates the Tel1/ATM axis of the DNA damage response. The EMBO Journal (2023)42:e112684. doi: 10.15252/embj.2022112684 PMID: 37303233
Contact
Laboratoire
Centre de recherche en biologie cellulaire de Montpellier – CRBM (CNRS/Université de Montpellier)
1919 Route de Mende
34293 Montpellier cedex 5