Des cellules lymphoïdes innées contre Mycobacterium tuberculosis
Le rôle des cellules lymphoïdes innées (ILC) lors de l’infection tuberculeuse est mal connu. Une étude publiée dans la revue Cell Reports montre que l’infection de souris conduit à la différenciation locale d’ILC appelées « ILC1-like » à partir de précurseurs immatures. Les ILC1-like présentent un phénotype et un métabolisme distinct, ont un potentiel protecteur et leur génération, stimulée par la vaccination BCG, met en lumière leur importance possible dans la protection contre la tuberculose.
La tuberculose reste l'une des maladies infectieuses les plus meurtrières, avec environ 10 millions de nouveaux cas et plus de 1,5 million de décès chaque année. Les recherches sur les défenses immunitaires contre le bacille de la tuberculose, M. tuberculosis, sont largement dominées par l'étude de la contribution des macrophages, les principales cellules infectées par le bacille dans les poumons, et des lymphocytes T. De nouveaux acteurs de l’immunité antituberculeuse, et notamment des cellules immunitaires non-conventionnelles résidant dans les tissus sont actuellement l’objet d’importantes recherches. Parmi ces cellules, les cellules lymphoïdes innées (ou ILC) représentent une population cellulaire découverte il y a seulement 15 ans. Ces cellules résident dans les tissus où elles jouent un double rôle dans le maintien de l'intégrité des tissus et la protection contre les infections par des agents pathogènes. Les cellules lymphoïdes innées existent en différentes populations appelées ILC1, ILC2 et ILC3 en fonction de leurs propriétés biologiques. Dans le tissu pulmonaire de la souris, les ILC2, population majoritaire d’ILC, jouent un rôle critique dans des pathologies telles que l’asthme et les infections parasitaires. A l’inverse, les ILC1 et les ILC3 contribuent à l’immunité contre les pathogènes intracellulaires (virus, bactéries) et extracellulaires (bactéries, champignons) respectivement. La manière dont ces cellules, présentes dans le tissu au moment de l’infection, sont influencées par l’infection par M.tuberculosis et contribuent à l’immunité antituberculeuse commence a être explorée.
Dans le cadre d'une collaboration internationale, les scientifiques ont découvert que, pendant l'infection de la souris par M. tuberculosis, les cellules lymphoïdes innées se comportent différemment : alors que les ILC1 et ILC3 se développent et s'activent, les ILC2 se contractent et deviennent fonctionnellement inhibées. Les chercheurs ont découvert qu'une population atypique partageant des caractéristiques communes avec les ILC1 tout en étant distincte, appelée cellules « ILC1-like », apparaît dans les poumons des souris infectées.
Étant donné que les précurseurs immatures des ILC présents dans les poumons augmentent également au cours de l'infection et commencent à exprimer des marqueurs ILC1, les scientifiques ont émis l'hypothèse que les cellules ILC1-like pouvaient provenir de ces ILC immatures. À l'aide d'une série d'approches, ils ont découvert que l'environnement inflammatoire et métabolique a un impact sur les précurseurs immatures des cellules ILC du poumon pour les inciter à se différencier en cellules ILC1-like. Les cytokines, qui sont des médiateurs clés de la communication entre les cellules immunitaires, produites pendant l'infection par M. tuberculosis déterminent ce processus de différenciation en cellules ILC1-like. Ils ont également constaté que les cellules ILC1-like présentent un métabolisme distinct et que l'utilisation du glucose est essentielle à leur différenciation ainsi qu’à leur fonction. Enfin, ils ont découvert que les cellules ILC1-like ont le potentiel de protéger contre l'infection par M. tuberculosis et, fait intéressant, que l'administration intranasale du vaccin antituberculeux, le BCG, entraîne la génération de ces cellules.
Dans l’ensemble, ces résultats soutiennent un modèle dans lequel une population de précurseurs contribue à la différenciation locale des cellules protectrices ILC1-like sous l’influence d’un environnement inflammatoire et métabolique induit par l’infection par M. tuberculosis. Cette étude fournit les bases pour explorer davantage le potentiel des cellules ILC1-like dans les domaines infectieux mais aussi non-infectieux. Des approches visant à induire ou à inhiber spécifiquement la différenciation des cellules ILC1-like pourraient aider à comprendre leur contribution dans divers contextes physio-pathologiques et offrir de nouvelles stratégies d’intervention immunologiques.
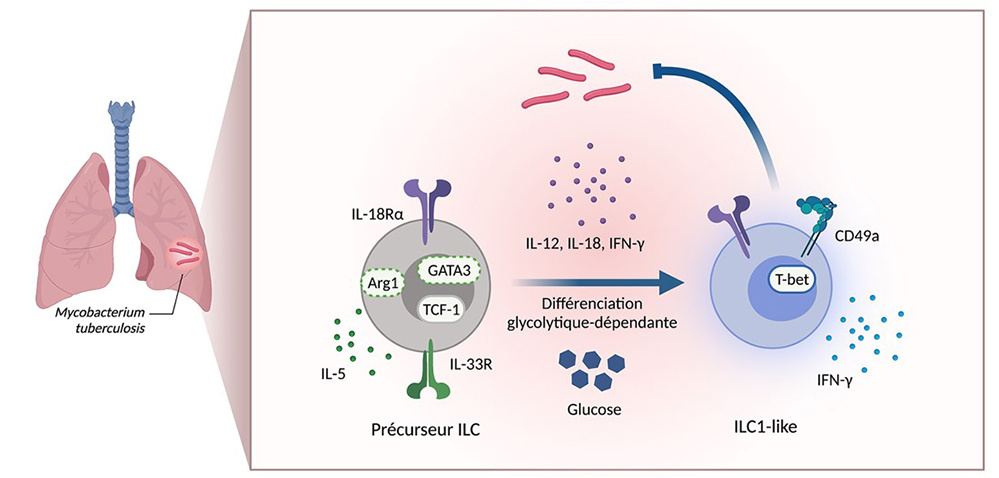
Figure : Des cellules précurseurs des ILC caractérisées par l’expression du récepteur l'interleukine-18 (IL18Ra) et du facteur de transcription TCF-1 résident dans le tissu pulmonaire. En condition homéostatique, ces cellules présentent un biais vers un phénotype ILC2 (expression du facteur de transcription GATA3, du facteur métabolique Arg1 et l’expression de l’interleukine-5 (IL-5). Lors de l'infection par M. tuberculosis, l’inflammation induite dans les poumons, entraîne la production de cytokines telles que l’IL-12, IL-18 et l’IFN-g. Cet environnement inflammatoire va façonner le devenir des cellules précurseurs en favorisant l’acquisition d’un phénotype de type ILC1 tels que l’expression du facteur de transcription T-bet, de l’intégrine CD49a ou de l’IFNg, tout en défavorisant un phénotype ILC2. De plus, ce processus de différenciation requiert l’induction d’un programme glycolytique dépendant de la présence de glucose dans l’environnement métabolique. Les cellules ILC1-like nouvellement différenciées présentent des capacités protectrices et peuvent participer à l’élimination de M. tuberculosis des poumons. (Créé avec BioRender.com)
Pour en savoir plus :
ILC precursors differentiate into metabolically distinct ILC1-like cells during Mycobacterium tuberculosis infection
Dan Corral, Alison Charton, Maria Z Krauss, Eve Blanquart, Florence Levillain, Emma Lefrançais, Tamara Sneperger, Zoï Valhas, Jean-Philippe Girard, Gérard Eberl, Yannick Poquet, Jean-Charles Guéry, Rafael J Arguello, Yasmine Belkaid, Katrin D Mayer-Barber, Matthew R Hepworth, Olivier Neyrolles et Denis Hudrisier
Cell Reports, 19 avril 2022. DOI:https://doi.org/10.1016/j.celrep.2022.110715
Contact
Laboratoire
Institute of Pharmacology and Structural Biology (IPBS) (CNRS/Université Toulouse III - Paul Sabatier)
205 route de Narbonne
31077 Toulouse Cedex 04