Découverte d’une protéine d’intérêt chez le trypanosome vecteur de la maladie du sommeil
Trypanosoma brucei est un parasite responsable de graves maladies chez l’Homme et le bétail en Afrique. Dans une étude publiée dans Current Biology, des scientifiques ont identifié une nouvelle protéine, appartenant à la superfamille des dynamines, qui joue un rôle central dans la modulation de la structure de la mitochondrie, la centrale énergétique de la cellule, de ce parasite. Ces travaux ouvrent de nouvelles perspectives pour la mise au point de traitements moins toxiques.
Trypanosoma brucei, le parasite responsable de la maladie du sommeil
L’Afrique, l’Amérique latine et certaines régions d’Asie sont confrontées à un lourd fardeau : les maladies transmises par des insectes, comme les moustiques ou les mouches tsé-tsé. Ces maladies, souvent négligées, ne se limitent pas à ravager la santé des populations. Elles freinent aussi fortement le développement agricole, économique et social de régions entières. Parmi ces maladies, on trouve la tristement célèbre maladie du sommeil, provoquée par un parasite appelé Trypanosoma brucei. Ce parasite se transmet à l’humain et aux animaux via une piqûre de la mouche tsé-tsé. Chez l’humain, il cause de graves troubles neurologiques et chez les animaux, il provoque la nagana, une maladie qui affecte fortement le bétail. Le tableau s’assombrit davantage lorsque l’on considère que les traitements actuels sont rares, toxiques et de moins en moins efficaces en raison de l’émergence de résistances.
Chez ce parasite, une mitochondrie unique change de forme et de fonction
Contrairement à la plupart des cellules vivantes qui possèdent plusieurs mitochondries (les "centrales énergétiques" de la cellule), Trypanosoma brucei n’en possède qu’une seule, qui change totalement de forme et de fonctionnement selon l’environnement, impliquant des mécanismes de fusion et fission membranaires. Dans la mouche tsé-tsé, la mitochondrie du parasite se présente sous une forme réticulée, de grande taille et très active, produisant de l’énergie via un processus complexe appelé phosphorylation oxydative. Mais une fois dans le sang du mammifère, la mitochondrie du parasite se réduit considérablement sous la forme d’un simple tube, et le parasite utilise principalement les sucres (le glucose) pour produire de l’énergie, par un processus beaucoup plus simple : la glycolyse.
Chez la plupart des êtres vivants, les mitochondries sont très dynamiques : elles fusionnent ou se divisent constamment pour s’adapter aux besoins de la cellule. Ces processus, bien décrits chez les cellules de mammifères ou chez la levure Saccharomyces cerevisiae (la levure de boulanger) sont régulés par des protéines de la famille des dynamines. Ces protéines possèdent un domaine hydrolysant le GTP et des structures leur permettant de se lier aux membranes et de s’oligomériser. Chez Trypanosoma brucei, la mitochondrie forme un réseau unique et continu, très particulier, qui ne se divise qu’au moment où la cellule elle-même se divise. Jusqu’à récemment, seules des protéines impliquées dans la fission(la division des mitochondries) avaient été identifiées chez ce parasite. Les protéines responsables de la fusion, présentes chez les humains ou les levures (comme Mfn ou Opa1), semblaient tout simplement absentes, suggérant un mécanisme de fusion différent.
Une nouvelle protéine de la famille des dynamines pourrait être à l’origine de cette particularité
Dans un article publié dans la revue Current Biology, les scientifiques ont découvert chez Trypanosoma brucei un nouveau type de protéine de la famille des dynamines, baptisée TbMfnL (Trypanosoma brucei Mitofusin-Like). Cette protéine semble issue d’une ancienne famille de protéines, présente chez de nombreux êtres vivants (incluant certaines bactéries), mais absente des mammifères et des levures. Elle pourrait donc être un vestige ancien d’un mécanisme de remodelage des membranes cellulaires. Leurs résultats montrent que TbMfnL est ancrée dans la membrane interne de la mitochondrie, côté matrice (l’intérieur de la mitochondrie), ce qui est inédit pour des protéines remodelant les membranes mitochondriales. En augmentant la production de TbMfnL dans la cellule, les scientifiques ont observé une forte augmentation de l’interconnexion et de ramifications des filaments mitochondriaux, mécanisme dépendant de l’hydrolyse du GTP, qui fournit l’énergie nécessaire. En d’autres termes, TbMfnL serait capable de moduler la forme de la mitochondrie par l’intérieur, via un mécanisme totalement différent de celui qu’on observe chez les autres eucaryotes. Cette découverte ouvre la voie à une nouvelle compréhension des mécanismes de structuration des membranes mitochondriales et plus généralement des membranes cellulaires, non seulement chez Trypanosoma brucei, mais aussi chez d'autres organismes. À terme, cette découverte pourrait permettre de cibler plus efficacement le parasite, en attaquant un élément essentiel et qui lui est propre. Et pourquoi pas, développer des traitements plus spécifiques, moins toxiques, et épargnant les cellules humaines.
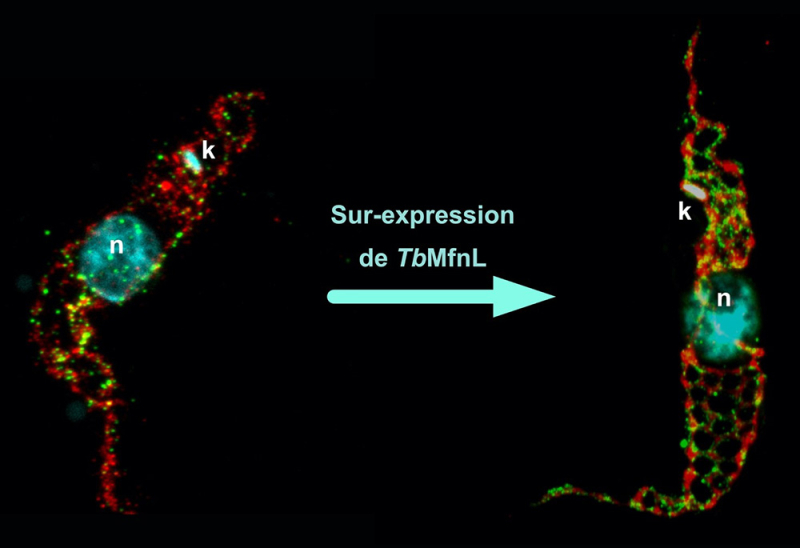
Figure : Marquage de la mitochondrie d’un trypanosome sauvage et sur-exprimant la protéine TbMfnL par microscopie d’expansion. Rouge, marquage de la matrice mitochondriale (Thréonine déshydrogénase, Tdh) ; Vert, marquage membranaire de la protéine TbMfnL ; Cyan, marquage du noyau (n) et de l’ADN mitochondrial (k, kinetoplaste).
Référence : Morel CA, Asencio C, Moreira D, Blancard C, Salin B, Gontier E, Duvezin-Caubet S, Rojo M, Bringaud F, Tetaud E. A new member of the dynamin superfamily modulates mitochondrial membrane branching in Trypanosoma brucei. Curr Biol. 2025 Mar 24;35(6):1337-1352.e5. doi: 10.1016/j.cub.2025.02.033. Epub 2025 Mar 12. PMID: 40081380.
Contact
Laboratoire
Microbiologie fondamentale et pathogénicité - MFP (CNRS/Université de Bordeaux)
146, Rue Léo Saignat
33000 Bordeaux