Découverte d’une nouvelle source de médicaments potentiels
Certaines éponges marines produisent des lipides cytotoxiques à partir desquels des analogues de synthèse particulièrement toxiques vis-à-vis de cellules cancéreuses ont été développées. Toutefois, leur mécanisme d’action restait énigmatique. Dans des travaux publiés dans la revue eLife, les scientifiques révèlent ce mécanisme et démontrent qu’il représente une source de nouvelles molécules à cytotoxicité sélective qui pourraient être utilisés contre le cancer, voire contre certaines maladies infectieuses selon le même principe.
De nombreux médicaments ont été inspirés par des molécules naturelles. Parmi les composés isolés d’organismes marins et présentant des propriétés médicinales potentielles, des lipides produits par les éponges marines et caractérisés par une fonction alcynylcarbinol ont longtemps attiré l’attention pour leurs propriétés cytotoxiques. Ces molécules naturelles ont inspiré le développement chimique d’une large famille de composés synthétiques hautement toxiques vis-à-vis de cellules tumorales. Toutefois, l’utilisation thérapeutique de ces molécules dépendait de la découverte de leur mécanisme d’action.
Pour élucider ce mécanisme, les scientifiques se sont concentrés sur les dérivés synthétiques les plus actifs de cette famille, appelés dialcynylcarbinols, environ 1000 fois plus toxiques que les molécules naturelles qui les ont inspirés. Ils ont sélectionné des cellules humaines haploïdes résistantes aux effets cytotoxiques de ces molécules. Dans l’ensemble des cellules résistantes, ils ont montré que le gène HSD17B11 était inactivé par des mutations. HSD17B11 est une enzyme dont la fonction physiologique est l’inactivation par oxydation d’un stéroïde endogène.
En combinant de nombreuses approches, les scientifiques montrent que HSD17B11 oxyde les lipides étudiés en des formes réactives qui vont aussitôt se fixer sur plusieurs protéines cellulaires essentielles impliquées dans le "contrôle qualité des protéines". Cette fixation bloque les processus associés et induit très rapidement l’accumulation de protéines incorrectes conduisant à la mort cellulaire. HSD17B11 est également nécessaire à la cytotoxicité des molécules apparentées, dont les molécules naturelles qui ont inspirés leur développement. Ces lipides sont donc des pro-drogues bioactivées par une enzyme cellulaire en des espèces réactives cytotoxiques.
Pour mieux définir leur potentiel anticancéreux, le criblage d’un panel de lignées tumorales a été entrepris et a permis de montrer qu’un cancer pédiatrique rare, l’ostéosarcome, est particulièrement sensible à ces molécules alors qu’elles n’ont aucun effet sur les lignées cancéreuses dépourvues de HSD17B11.
HSD17B11 n’est qu’une protéine parmi une très grande famille d’enzymes appelées les Short-chain Dehydrogenases/Reductases (SDRs) qui comprend plus de 500 000 représentants répartis dans l’ensemble des organismes vivants. Les chercheurs ont voulu montrer qu’il était possible de concevoir à partir de leurs composés de nouvelles molécules capables d’être activées sélectivement par d’autres SDRs en des composés cytotoxiques. Pour deux autres SDRs humaines, RDH11 et HPGD, ils ont ainsi pu développer de nouveaux lipides dont la cytotoxicité repose sur leur activation par ces enzymes. Ces travaux ouvrent donc la possibilité de développer des agents permettant d’éliminer sélectivement une cellule ou un organisme exprimant une SDR spécifique.
Ainsi, les molécules naturelles ou bio-inspirés de cette famille représentent une source de médicaments potentiels contre différentes pathologies dont le cancer et les maladies infectieuses. Les chercheurs ont déjà commencé à exploiter leurs résultats en développant de nouveaux agents anticancéreux prometteurs qu’ils ont brevetés.
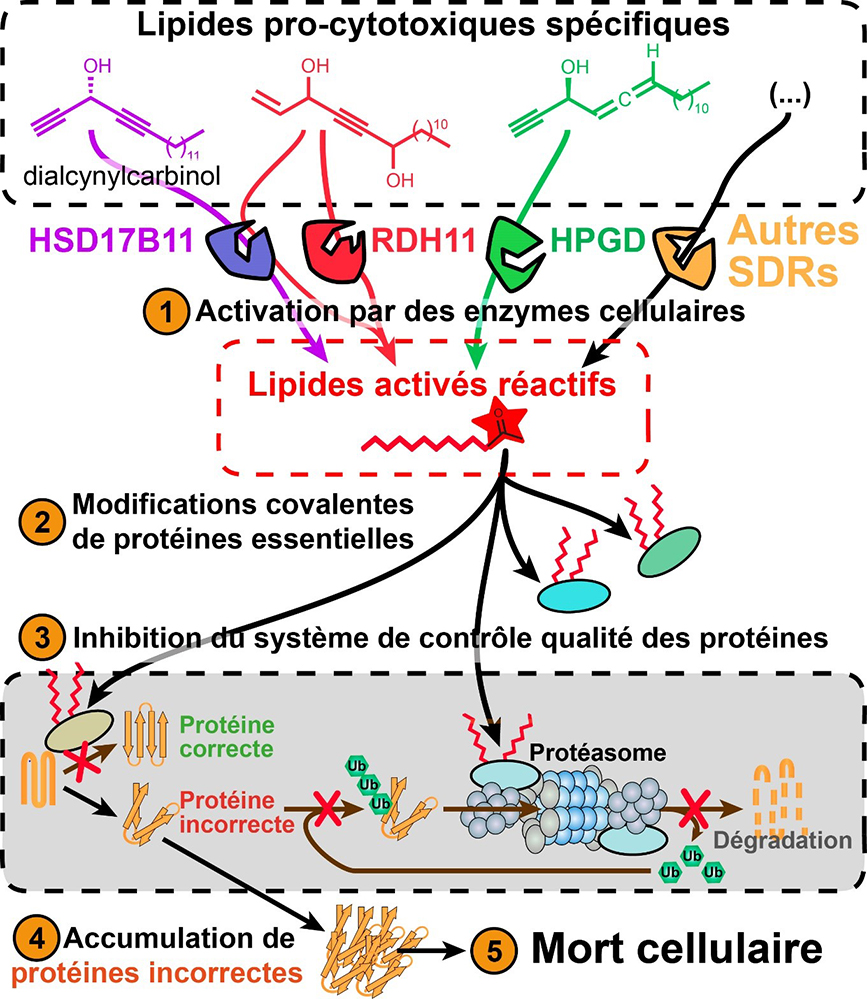
Figure : Des enzymes cellulaires, les Short-chain Dehydrogenases/Reductases (SDRs), sont capables (1) de convertir spécifiquement des lipides pro-cytotoxiques naturels et synthétiques en des lipides réactifs. Ces lipides activés vont (2) s’attacher de façon irréversible sur plusieurs protéines cellulaires essentielles impliquées dans le système de "contrôle qualité des protéines", qui permet notamment de s’assurer que les protéines qui n’ont pas été correctement repliées sont dégradées par le protéasome pour éviter qu’elles ne perturbent la cellule. Les modifications des protéines de ce système par les lipides activés conduisent à son inhibition ce qui provoque (4) l’accumulation de protéines incorrectes et aboutit rapidement à (5) la mort cellulaire.
Pour en savoir plus :
SDR enzymes oxidize specific lipidic alkynylcarbinols into cytotoxic protein-reactive species
Demange P., Joly E., Marcoux J., Zanon P.R.A., Listunov D., Rullière P., Barthes C., Noirot C., Izquierdo J.-B., Rozié A., Pradines K., Hee R., de Brito M.V., Marcellin M., Serre R.F., Bouchez O., Burlet-Schiltz O., Oliveira M.C.F., Ballereau S., Bernardes-Génisson V., Maraval V., Calsou P., Hacker S.M., Génisson Y., Chauvin R., Britton S.
eLife 10 mai 2022; https://doi.org/10.7554/eLife.73913
Contact
Laboratoire
Institut de Pharmacologie et de Biologie Structurale (IPBS) – (CNRS/Université de Toulouse)
205 route de Narbonne
31077 Toulouse
France