Découverte d’une cascade transcriptionnelle anti-inflammatoire conservée depuis la drosophile jusqu’à l’homme
Dans une étude publiée dans la revue Cell Reports, les scientifiques dévoilent une cascade transcriptionnelle anti-inflammatoire conservée dans l’évolution depuis la drosophile jusqu’à l’homme. L’absence du facteur de transcription Gcm conduit à une réponse inflammatoire accrue dans des états inflammatoires chroniques tels que le vieillissement ainsi que dans les états inflammatoires aigus. De plus, cette cascade anti-inflammatoire est fonctionnelle chez l’homme et est impliquée chez les patients affectés par la sclérose en plaques.
La réponse immunitaire innée est un processus ancestral qui peut induire des états pro- et anti-inflammatoires. Une réponse adéquate à l’inflammation est fondamentale car elle permet à l’organisme de réagir de manière appropriée, ni trop ni trop peu, tout déséquilibre étant nuisible. L’inflammation chronique est typique du vieillissement, et un état inflammatoire est associé à de nombreuses pathologies humaines, des maladies neurodégénératives jusqu’au cancer. Un des défis majeurs porte actuellement sur l’identification de cascades transcriptionnelles qui contrôlent l’expression simultanée de plusieurs gènes effecteurs, qui régissent ainsi l’intensité de la réponse à l’inflammation.
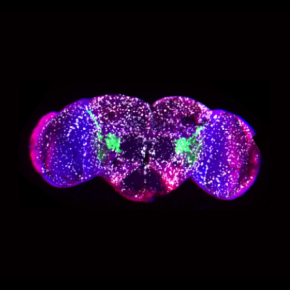
Dans cette étude, les scientifiques ont identifié une cascade anti-inflammatoire conservée dans l’évolution. Ils démontrent que, chez la drosophile, l’expression du facteur de transcription macrophage-spécifique Gcm/Glide est induite après un challenge aigu et aussi dans des cellules étroitement associées au cerveau âgé (état inflammatoire chronique). De même, ils montrent que l’expression du gène orthologue murin mGcm2 est spécifiquement induite dans la microglie de souris âgées, la microglie étant constituée de cellules appartenant à la lignée des macrophages. Ces cellules sont étroitement liées aux pathologies neurodéveloppementales, cognitives et neurodégénératives ainsi qu’aux tumeurs du système nerveux. En accord avec le rôle anti-inflammatoire montré chez la drosophile, chez les souris mutantes pour mGcm2 dans la microglie, cette population cellulaire se trouve dans un état inflammatoire dans des souris âgées. En utilisant un modèle de challenge inflammatoire aiguë (i.e. l’injection dans la moelle épinière de lysophosphatidylcholine (LPC)), les scientifiques ont montré que mGcm2 est induit dans les cellules immunitaires au niveau de la lésion de la moelle épinière. Les souris dont la microglie est mutée pour mGcm2 déploient une réaction inflammatoire beaucoup plus importante que les animaux contrôle. Enfin, chez les patients atteints de sclérose en plaque, maladie inflammatoire et démyélinisante, l’expression du facteur de transcription hGCM2 est observée spécifiquement dans les régions dans lesquelles l’inflammation est en cours, les plaques dites « actives ».
Cette étude s’appuie sur des analyses menées dans des modèles vertébrés et invertébrés ainsi que sur des biopsies port-mortem humaines. Ce travail initié chez la drosophile apporte aussi une contribution originale en recherche médicale sur un processus à présent encore peu compris. L’identification d’un facteur de transcription à effet anti-inflammatoire chez la drosophile montre l’importance des modèles animaux simples, qui permettent le déploiement d’outils génétiques sophistiqués. La compréhension du mode de fonctionnement de la cascade transcriptionnelle relayée par Gcm ouvre aussi de nouvelles voies d’identification de molécules d’intérêt thérapeutique pouvant être testées chez des modèles mammifères plus proches de l’être humain, dans le respect de la règle européenne des trois R (Replacer, Réduire, Raffiner).
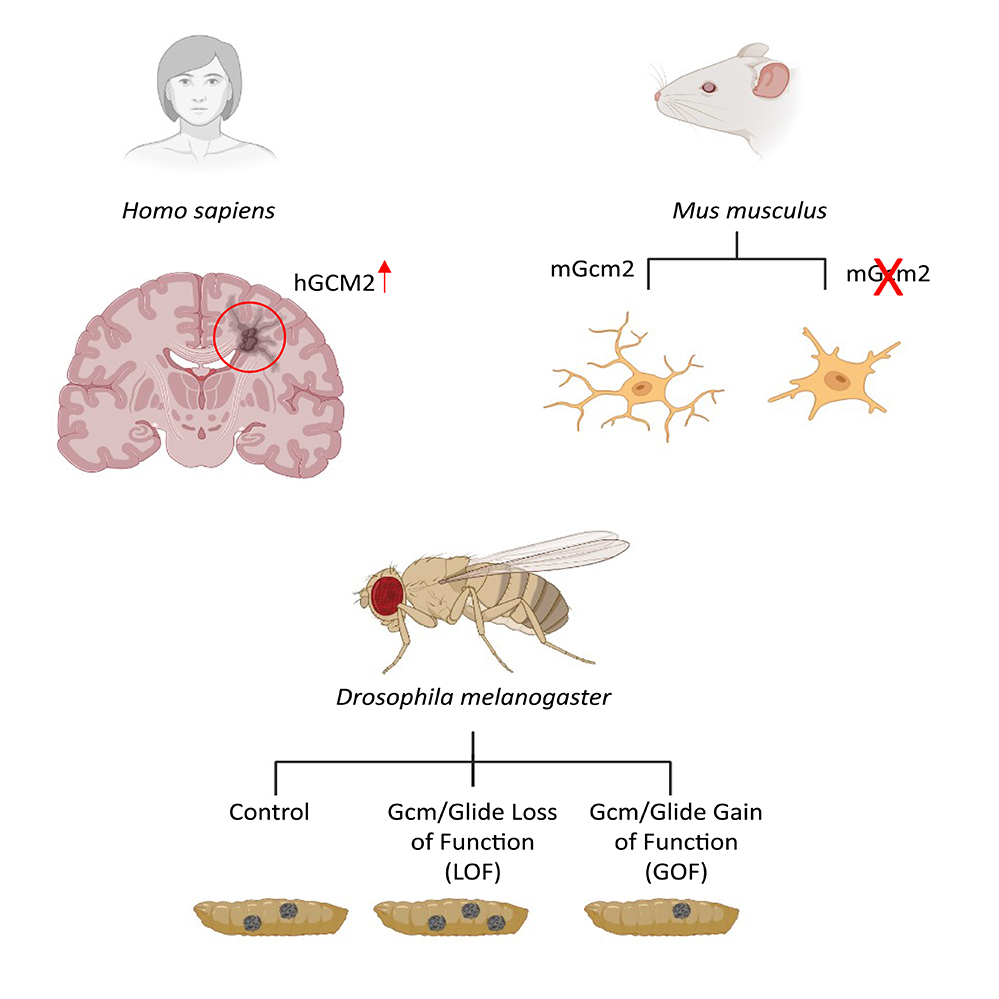
Figure : Chez les patients affectés par la maladie démyélinisante et inflammatoire appelée sclérose en plaque, l’expression du facteur de transcription hGCM2 est spécifiquement induite dans les plaques actives, là où la réponse inflammatoire est présente. Chez les souris âgées qui sont défectueuses pour le facteur orthologue mGcm2 spécifiquement dans les macrophages du cerveau appelés microglie, ces cellules se trouvent dans un état inflammatoire. Chez la drosophile, les larves infestées par une guêpe parasitoïde conduit à une réponse inflammatoire impliquant la prolifération des cellules immunitaires qui forment des masses dites mélanotiques. Chez les animaux défectueux pour le facteur Gcm/Glide, la réponse inflammatoire est accrue par rapport à ce qui est observé chez les animaux contrôle (plus de masses mélanotiques), alors que chez les animaux dans lesquels on surexprime ce facteur, la réponse est moins forte (moins de masses mélanotiques).
Pour en savoir plus :
Pavlidaki A, Panic R, Monticelli S, Riet C, Yuasa Y, Cattenoz PB, Nait-Oumesmar B, Giangrande A.
Cell Rep. 2022 Oct 18;41(3):111506. doi: https://doi.org/10.1016/j.celrep.2022.111506
Contact
Laboratoire
Institut de génétique et de biologie moléculaire et cellulaire - IGBMC (CNRS/Inserm/Université de Strasbourg)
1 Rue Laurent Fries
67400 Illkirch-Graffenstaden