Découverte d’un nouvel acteur de la régulation de l’élongation bactérienne
Dans un article publié dans EMBO reports, des scientifiques ont identifié le rôle d’une protéine encore méconnue, RagB. Ce travail, réalisé chez Bacillus subtilis, révèle un niveau de régulation inédit de la synthèse du peptidoglycane, un polymère de la paroi cellulaire qui donne sa forme et sa rigidité à la bactérie. À long terme, ce travail ouvre des perspectives pour de nouvelles cibles antibactériennes.
Le peptidoglycane, un constituant clé de la paroi cellulaire des bactéries
Chez la plupart des bactéries, la paroi cellulaire contient une molécule appelée peptidoglycane. Ce polymère composé de molécules de sucres et de peptides agit comme une armature : il donne sa forme à la bactérie et la protège en assurant rigidité et résistance. Pour fabriquer et réparer ce peptidoglycane, les bactéries utilisent des enzymes spécialisées.
Deux grandes familles de protéines participent à ce processus :
- Les PBP (protéines de liaison à la pénicilline), connues depuis longtemps et déjà ciblées par des antibiotiques comme la pénicilline.
- Les protéines SEDS (Shape, Elongation, Division and Sporulation) découvertes plus récemment. Elles sont tout aussi essentielles, mais ne sont pas encore utilisées comme cibles d’antibiotiques.
Ces protéines possèdent une activité enzymatique :
- Les PBP de classe B (bPBP) réalisent des liaisons entre peptides (activité transpeptidase).
- Les protéines SEDS ajoutent de nouveaux éléments sucrés au polymère (activité glycosyltransférase).
Ces deux activités sont essentielles pour la synthèse du peptidoglycane. Lorsque la cellule s’allonge, c’est le complexe d’élongation, appelé élongasome qui entre en jeu. Ce complexe inclut notamment RodA, une protéine SEDS, et une bPBP. Ensemble, elles assurent la synthèse latérale du peptidoglycane, permettant à la bactérie de grandir sans perdre sa rigidité.
- Les PBP de classe A (aPBP), quant à elles, sont bifonctionnelles et possèdent une activité transpeptidase et glycosyltransférase. Elles participent à la réparation et au renforcement du peptidoglycane.
Si plusieurs régulateurs de PBP ont été identifiés chez diverses bactéries, aucun régulateur de protéines SEDS n’avait été caractérisé jusqu’alors.
RagB : un booster pour l’enzyme RodA
Dans une étude récente réalisée chez Bacillus subtilis, des scientifiques ont montré que la protéine RagB agit comme un booster pour l’enzyme RodA, un des piliers de l’élongasome.
Les expériences montrent que :
- Lorsque les aPBP sont inactivées (par un antibiotique ou une mutation), la survie des bactéries dépend fortement de la présence de la protéine RagB et de la surproduction de RodA.
- Sans RagB, même une production accrue de RodA ne suffit pas à maintenir la croissance.
Ces observations montrent que l'activité de RodA dépend de RagB.
De plus, en l’absence de PBP1A, la principale aPBP, l’absence de RagB peut être compensée par la surproduction de RodA. Aucun effet de RagB n’a été observé sur le niveau d'expression du gène rodA, ni sur la localisation et la dynamique cellulaire de RodA dans l’élongasome. Toutefois une interaction a été démontrée entre RagB et RodA suggérant que RagB stimule directement l'activité de RodA. Ainsi, RagB devient essentielle en l'absence des aPBP et pourrait recruter RodA au niveau des lésions du peptidoglycane à réparer.
Une nouvelle piste contre les bactéries ?
Ce travail met en lumière un nouveau niveau de régulation de la synthèse du peptidoglycane en révélant comment l’activité d’une protéine de l’élongasome peut être modulée par RagB. À terme, ce mécanisme pourrait ouvrir des perspectives pour de nouvelles cibles antibactériennes.
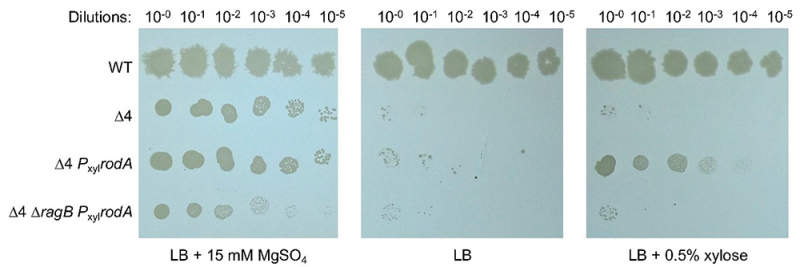
Figure : La surproduction de RodA ne permet la croissance de la souche Δ4 (délétée des gènes des 4 aPBP) qu’en présence de RagB. Des dilutions en série ont été réalisées avec quatre souches de Bacillus subtilis. Toutes se développent sur milieu LB en présence de magnésium. Toutefois, seule la souche de type sauvage (WT) est capable de croître sur milieu LB, tandis que les souches Δ4, délétées des quatre gènes codant les aPBP, n’y parviennent pas. En revanche, la souche Δ4 Pxyl-rodA peut se développer sur ce milieu lorsqu’elle surproduit RodA en présence de xylose. Par contre, ni la souche Δ4 sans surproduction de RodA, ni la souche Δ4ΔragB Pxyl-rodA (surproduisant RodA en présence de xylose mais délétée de RagB) ne présentent de croissance sur milieu LB contenant l’inducteur. Ces résultats suggèrent que l’activité de RodA est stimulée par la présence de RagB.
En savoir plus : Pompeo F, Foulquier E, Chastanet A, Espinosa L, Billaudeau C, Rodrigues A, Cornilleau C, Carballido-López R, Galinier A. RagB stimulates the activity of the peptidoglycan polymerase RodA in Bacillus subtilis. EMBO Rep. 2025 Aug 15. doi: 10.1038/s44319-025-00547-w. Epub ahead of print. PMID: 40817173.
Contact
Laboratoire
Laboratoire de chimie bactérienne - LCB (CNRS/Aix-Marseille Université)
31 Chemin Joseph Aiguier
13009 Marseille - France