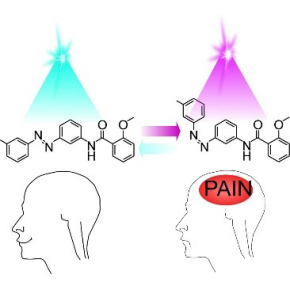
Contrôle de la douleur par la lumière
Dans un article publié dans la revue Nature Communications, des scientifiques ont développé une technique permettant de télécommander instantanément et réversiblement par la lumière le comportement animal lié à la douleur. Cette méthode ne requiert ni manipulation génétique, ni chirurgie, ni infection virale mais seulement l’injection d’un composé pharmacologique et peut s’appliquer des vers aux mammifères. En contrôlant ainsi de manière réversible le signal douloureux, ce protocole participera à la découverte et validation de nouvelles molécules analgésiques.
La douleur, en particulier lorsqu’elle devient chronique, représente la première cause de consultation médicale et constitue un enjeu majeur en santé publique. A l’heure actuelle, les analgésiques disponibles sur le marché manquent souvent d’efficacité et présentent tous des effets secondaires entravant la qualité de vie des patients. Développer de nouveaux analgésiques est l’un des enjeux que les scientifiques essayent de relever.
Pour étudier la douleur, il faut pouvoir l’induire, et c’est là un des problèmes majeurs dans ce domaine. En effet, les stimuli d’induction de la douleur habituellement utilisés ont une faible résolution spatio-temporelle, génèrent des réactions ayant une grande variabilité, mais surtout sont invasifs. Pour toutes ces raisons, l’analyse in vivo des voies de la douleur est limité, pour des raisons éthiques évidentes, limitant ainsi que la recherche de nouvelles molécules de prise en charge de la douleur.
Des scientifiques ont mis au point une méthode d’optopharmacologie qui permet de contrôler avec une grande précision spatiotemporelle l’excitabilité des neurones impliqués dans la douleur chez l’animal éveillé par une simple impulsion de lumière dans l’ultraviolet (UV). En contrôlant ces neurones, il est ainsi possible de contrôler le comportement douloureux de façon réversible et ceci chez le ver nématode C. elegans comme chez la souris.
Le composé chimique développé, LAKI, est inactif en lumière ambiante et il peut être activé par une illumination dans l’UV, de manière instantanée, réversible et reproductible à l’infini. Après une simple injection de LAKI et son activation en lumière UV, le signal douloureux est transmis au système nerveux.
Les applications de ce nouvel outil sont multiples. Il permettra par exemple l’étude des voies de la douleur chez la souris de manière plus éthique puisqu’il sera possible de réduire au maximum les signaux douloureux. De plus, les mécanismes cellulaires de la douleur sont conservés au cours de l’évolution : ainsi, dans un autre modèle de laboratoire, le ver nématode incubé dans un bain contenant LAKI, la lumière induit un comportement d’échappement (le ver se met à tourner en rond au lieu de nager). Ce comportement est inhibé si on ajoute un analgésique tel que l’ibuprofène, le paracétamol ou le Néfopam. En combinant le modèle ver avec le composé LAKI, il est désormais possible de cribler à large échelle de nouvelles molécules analgésiques sans recourir à la génétique ou la chirurgie.
Cette étude lève un verrou conceptuel et va permettre maintenant de rechercher de nouveaux analgésiques en criblant à haut débit l’effet de nouvelles molécules sur les nématodes. Il est dès lors possible, sans infliger une douleur permanente à un mammifère, de caractériser les drogues validées par un premier criblage chez le nématode. Enfin, en disséquant le mode d’action de la molécule, les scientifiques ont mis en évidence que la forme activée par les UV agit sur les protéines membranaires TREK1, TREK2 et TRESK responsables des flux d’ions potassium dans les cellules. L’utilisation de LAKI ouvrira donc également de nouvelles pistes dans l’étude des signaux contrôlés par TREK1, TREK2 et TRESK dont l’activité pourra désormais être finement télécommandée grâce à LAKI.
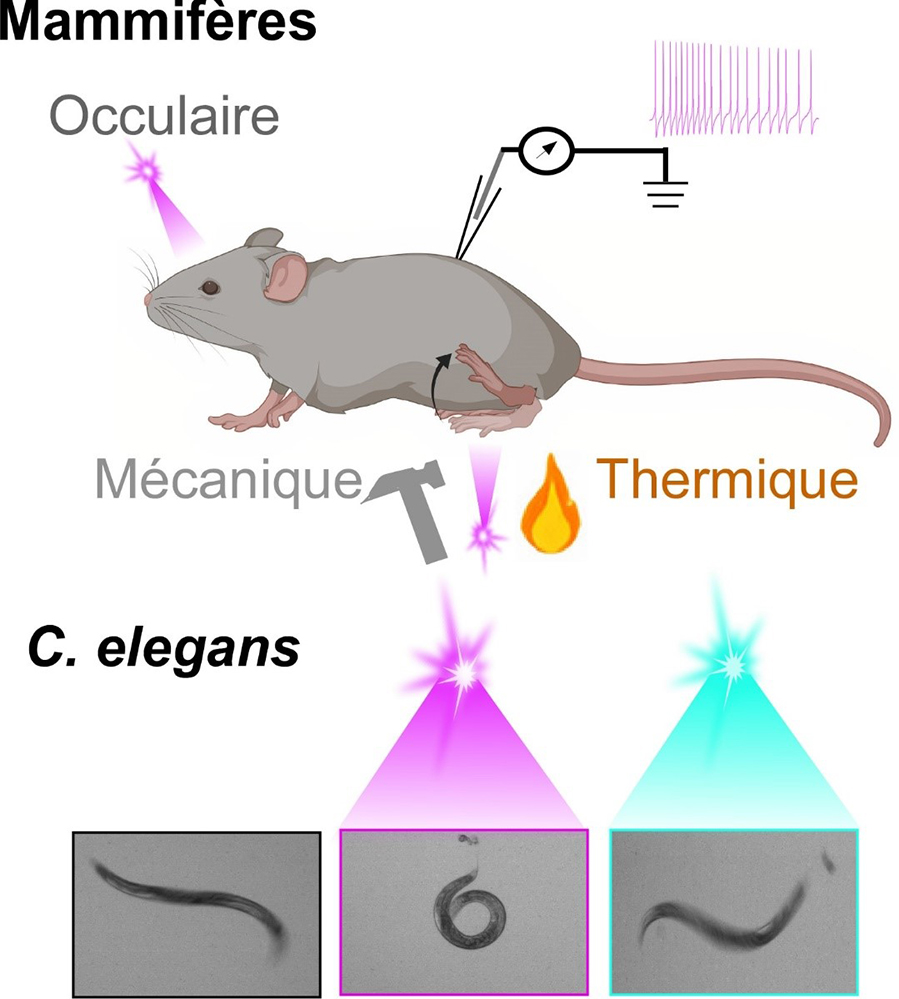
Figure : Contrôle de la douleur par la lumière.
Alors que dans le noir ou dans la lumière visible, la souris et le nématode ne ressentent pas la douleur, une impulsion de lumière dans l’UV induit instantanément un comportement douloureux qui peut être arrêter par une impulsion de lumière dans le bleu.
Pour en savoir plus :
A photoswitchable inhibitor of TREK channels controls pain in wild-type intact freely moving animals.
Landra-Willm A, Karapurkar A, Duveau A, Chassot AA, Esnault L, Callejo G, Bied M, Häfner S, Lesage F, Wdziekonski B, Baron A, Fossat P, Marsollier , Gasull , Boué-Grabot, Kienzler K and Sandoz G.
Nature Communications, 01 March, 2023. DOI:https://doi.org/10.1038/s41467-023-36806-4
Contact
Laboratoire
Institut de biologie Valrose - iBV (CNRS/Inserm/Université Côte d'Azur)
Université Côte d'Azur
Bât Biochimie - Fac.de science
PARC VALROSE
06108 NICE CEDEX 2