Construire un système nerveux fonctionnel
Le système nerveux central (SNC) est le système le plus complexe du corps humain en terme d’architecture comme en terme fonctionnel. Il assure des fonctions aussi complexes que le mouvement et la pensée. Le SNC est composé uniquement de deux types cellulaires: les neurones et les cellules gliales. Les neurones assurent la transmission de l’influx nerveux alors que les cellules gliales sont nécessaires à la fonction des neurones et à leur développement. Cette étude publiée le 25 Janvier 2018 dans la revue Neuron (dont elle illustre la page de couverture) montre comment ces deux types cellulaires s’organisent au cours du développement afin de former un SNC fonctionnel.
Malgré une composition cellulaire simple (neurones et cellule gliales), la morphologie et la fonction de ces cellules composant le SNC sont extrêmement complexes et variées. Afin d’établir des interactions fonctionnelles, ces deux types cellulaires coopèrent au cours du développement. Du fait de la complexité du SNC et du manque d’outils biologiques, les mécanismes contrôlant cette coopération sont peu étudiés.
Les chercheurs de l’Institut de Génomique Fonctionnelle de Lyon en collaboration avec le laboratoire de Richard Mann à l’université Columbia de New York ont utilisé un modèle biologique puissant, la drosophile, qui permet d’étudier la complexité du SNC grâce à des outils génétiques de pointe comme par exemple la technique MARCM qui permet de visualiser des cellules issues d’un même lignage ou la technique Flybow qui permet de visualiser des cellules uniques. Ils ont développé des techniques qui permettent de visualiser des neurones et des cellules gliales au niveau cellulaire et de modifier leur programme génétique afin d’étudier leur développement. Ils ont notamment modifié la technique du QMARCM/MARCM afin de visualiser avec deux protéines fluorescentes différentes les motoneurones et les cellules gliales issus du même lignage (nom de la technique :Cis-MARCM, figure D). En utilisant ces outils, ils ont étudié les régions du SNC qui prennent en charge la marche. Dans ces régions, appelées neuromères thoraciques chez la drosophile, les chercheurs ont analysé le développement des motoneurones (MNs) (neurones contrôlant la contraction musculaire), des astrocytes (cellules gliales contrôlant le développement, la fonction et l’homéostasie des motoneurones) et les cellules gliales de recouvrement (cellules gliales entourant les axones comme les oligodendrocytes chez les vertébrés).
Ils ont ainsi montré que – 1°) les même cellules souches produisent les MNs, les astrocytes et les cellules gliales entourant les axones -2°) le développement des cellules gliales et des MNs est coordonné afin de construire des unités fonctionnelles (les neuromères) - 3°) les MNs et les cellules gliales, alors qu’elles sont produites par les mêmes cellules souches, utilisent des mécanismes différents dans la construction de ces unités fonctionnelles. La morphologie unique et invariable (entre individus) des motoneurones est sous le contrôle d’une combinaison de facteurs de transcription exprimée de manière différentielle dans chaque MN. De façon surprenante, il n’a pas été trouvé de combinaison de facteurs de transcription exprimée dans des sous populations d’astrocytes ou des cellule gliales de recouvrement qui puissent contrôler la morphologie de ces cellules gliales. Au contraire, les chercheurs ont montré que les cellules gliales utilisent un mode de développement plastique. Cette plasticité se caractérise par le fait qu’elles peuvent varier leur morphologie et leur nombre de division afin de s’adapter à l’architecture du réseau neuronal.
Ces découvertes suggèrent que le fait de partager un même lignage avec deux logiques de spécification différentes, programmée pour les MNs et plastique pour les cellules gliales, permet le développement robuste du SNC, son homéostasie et son évolution. La combinaison de facteurs de transcription exprimée dans chaque MN permet la mise en place d’un câblage précis et stéréotypé entre individus : les MNs vont innerver des muscles spécifiques et recevoir une information particulière par des interneurones. Malgré une morphologie neuronale stéréotypée entre individus, on peut observer quelques variations de celle-ci dans des populations isogéniques. Ces variations peuvent être dues à des erreurs de développement et la plasticité des cellules gliales permet probablement de s’adapter à ces erreurs.
Enfin, la plasticité des cellules gliales permet également une flexibilité de l’évolution du SNC. La morphologie des neurones est déterminée par une combinaison de facteurs de transcription et cette logique de développement est conservée au cours de l’évolution. Une même logique de développement chez les cellules gliales rendrait le système plus rigide et une évolution plus complexe. La plasticité des cellules gliales permettrait de s’adapter à tout changement de la morphologie des MNs au cours de l’évolution.
Les bases moléculaires de cette plasticité gliale sont inconnues. Tout dérèglement du contrôle fin de cette plasticité (division vs différenciation) pourrait engendrer des pathologies dramatiques telles que des tumeurs. Chez l’homme, 50% des cancers du CNS sont des glioblastomes de type astrocytaire. Cette prépondérance de cancer pourrait être due à une logique développementale différente entre les MNs et les cellules gliales. Les chercheurs de l’équipe cherchent actuellement les molécules impliquées dans cette plasticité gliale.
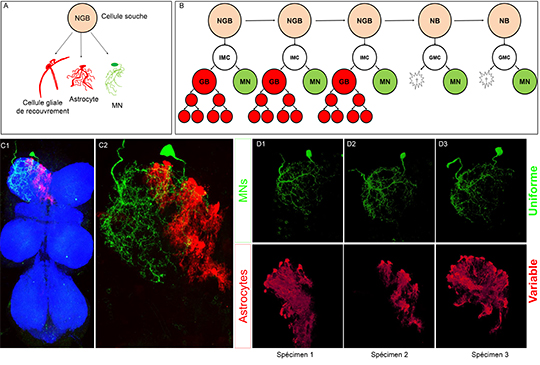
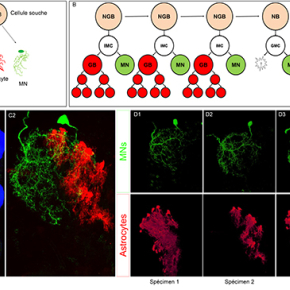
Schéma d’une cellule souche appelée neuroglioblaste (NGB) et de sa progénie diverse: motoneurones (MN), cellules gliales de recouvrement et astrocytes.
Schéma représentant un nouveau mode de division du NGB. Dans une première phase le NGB produit une IMC (cellule mère intermédiaire) qui produit des cellules gliales et des MNs. Dans un deuxième temps le NGB devient un neuroblaste produisant uniquement des motoneurones par l’intermédiare d’une GMC (cellule mère ganglionnaire)
Image confocale de la chaine nerveuse ventrale de la drosophile où uniquement la progénie de la première divison du NGB representé en B est marquée en vert (GFP, motoneurones) et en rouge (mCherry, astrocytes) en utilisant la technique cis-MARCM.
Diffèrents exemples du produit de la première division du NGB représenté en B où nous pouvons voir la variabilité du nombre et de la morphologie des astrocytes qui contraste avec la morphologie stéréotypée du motoneurone.
© Jonathan Enriquez
En savoir plus
-
Differing Strategies Despite Shared Lineages of Motor Neurons and Glia to Achieve Robust Development of an Adult Neuropil in Drosophila
Jonathan Enriquez, Laura Quintana Rio, Richard Blazeski, Stephanie Bellemin, Pierre Godement, Carol Mason, Richard S. Mann
Neuron 2018 Jan 25 ; https://doi.org/10.1016/j.neuron.2018.01.007 [Epub ahead of print]