Comprendre comment les cellules éliminent les médicaments qui les empoisonnent
Un grave problème de santé publique est la résistance aux médicaments. Ceci est notamment dû au fait que les cellules cancéreuses et les bactéries ou levures pathogènes disposent à leur périphérie des protéines qui captent et expulsent les médicaments, annulant ainsi leur effet. De nombreuses structures de ces protéines ont été déterminées dans leur phase de capture mais jamais pour la phase d’expulsion, empêchant d’avoir une compréhension complète du mécanisme. Dans le cadre d'une large collaboration, les scientifiques sont parvenus à isoler une de ces protéines avec son substrat avant expulsion, dont l’analyse de la structure révèle un mécanisme inattendu de transport en balancier. Les résultats sont publiés dans la revue Science Advances.
Les cellules cancéreuses de même que les bactéries ou levures pathogènes développent de multiples mécanismes pour empêcher l’action des médicaments administrés pour les tuer. Une première ligne de défense est la production de protéines que les cellules expriment à leur surface pour expulser les médicaments, réduisant la concentration de ces derniers à l’intérieur des cellules en deçà de leur seuil d’efficacité. Ces protéines, découvertes il y a plus de 50 ans, fonctionnent comme des pompes qui adoptent des conformations permettant la capture puis l’éjection du médicament. Différentes structures des protéines avec et sans médicament ont été résolues durant ces 20 dernières années, mais pas celle de la protéine dans sa conformation avec le médicament avant éjection, reflétant un état plus instable que les autres mais néanmoins critique pour élucider le mécanisme d’expulsion.
Les scientifiques y sont parvenus, tout d’abord en résolvant la structure apo de la protéine par diffraction des rayons X à l'aide de stabilisateurs moléculaires brevetés puis par cryo-EM en complexe avec le substrat. Ces structures ont permis de mettre en évidence la région de la pompe sollicitée pour la phase d’expulsion du médicament et observer comment sa flexibilité y contribue, résultats confirmés par des expériences d'échange proton-deutérium et de dynamique moléculaire.
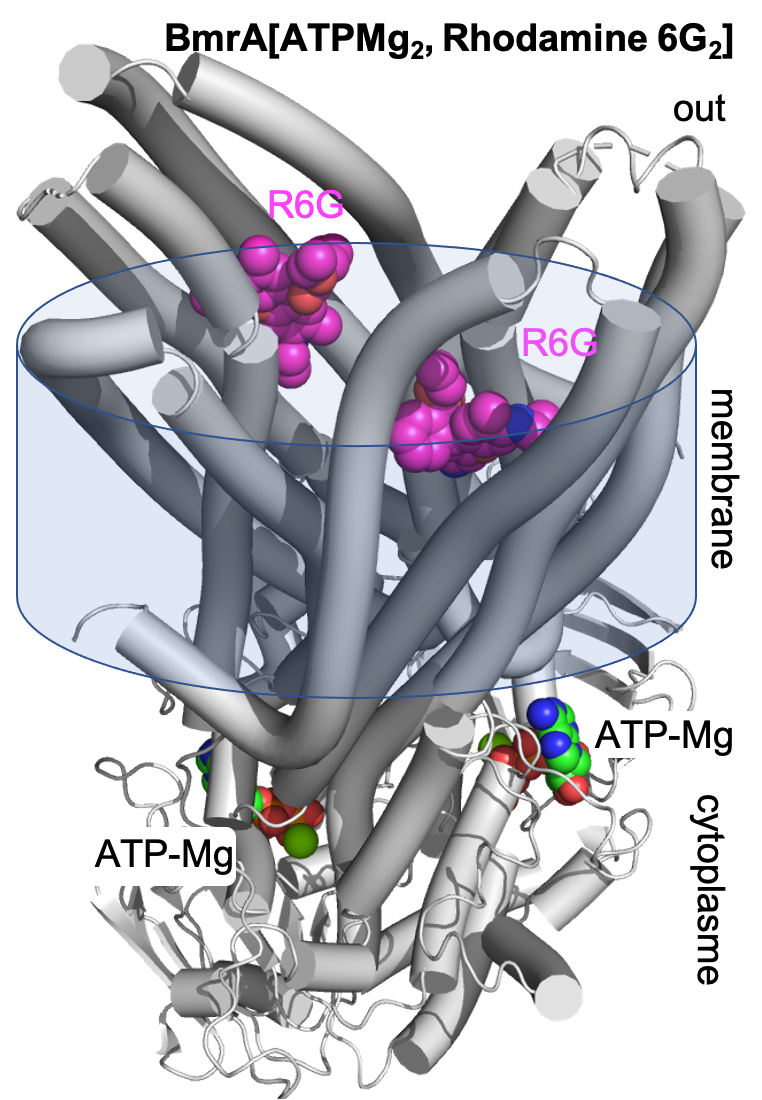
Figure : structure ouverte vers l’extérieur du transporteur ABC BmrA de Bacillus subtilis en complexe avec son substrat, la rhodamine 6G. La structure présente une région cytoplasmique et une région membranaire en conformation ouverte vers l’extérieur de la cellule, avec 2 molécules de rhodamine 6G liées.
Pour en savoir plus :
Substrate-bound and substrate-free outward-facing structures of a multidrug ABC exporter.
Chaptal V, Zampieri V, Wiseman B, Orelle C, Martin J, Nguyen KA, Gobet A, Di Cesare M, Magnard S, Javed W, Eid J, Kilburg A, Peuchmaur M, Marcoux J, Monticelli L, Hogbom M, Schoehn G, Jault JM, Boumendjel A, Falson P.
Sci Advances 28 janvier 2022. doi: 10.1126/sciadv.abg9215.
Contact
Laboratoire
Laboratoire de microbiologie moléculaire et biochimie structurale (CNRS – Université Claude Bernard, Lyon 1)
Institut de chimie et biologie des protéines
7, passage du Vercors
69367 Lyon