Comprendre Alzheimer : des petits anticorps prometteurs
Dans la maladie d’Alzheimer, la protéine tau défectueuse, s’accumule dans les cellules nerveuses et provoque leur mort. Mais, à la manière des prions, ces protéines tau sont également capables de se propager d’une cellule à l’autre. Dans un article publié dans Nature Communications, des scientifiques rapportent comment de petits anticorps anti-tau, appelés des nanocorps, peuvent bloquer l’internalisation de la protéine neuronale tau par les cellules. Cette découverte a des implications pour le développement futur de biothérapies.
Les maladies neurodégénératives, comme la maladie d’Alzheimer, se caractérisent par l'accumulation anormale de certains variants protéiques dans le cerveau. Ces protéines s'agglutinent à l'intérieur des neurones, perturbant leur fonctionnement, et se propagent dans les neurones voisins.
L’impact de la protéine Tau dans la maladie d’Alzheimer
Dans le cas de la maladie d’Alzheimer, c’est la protéine tau qui pose problème. Elle joue normalement un rôle important dans le squelette interne des cellules. Mais chez les personnes atteintes, cette protéine change de forme et s’agglutine dans les neurones. Cette forme pathologique, qu’elle soit monomérique ou fibrillaire, est également secrétée et captée par les neurones connectés. Ces variants de tau pourraient avoir des propriétés similaires à celles des prions, des protéines défectueuses qui imposent un changement pathologique aux protéines normales. Ces propriétés de type prion de tau sont associées à une propagation de cellule en cellule dans le cerveau, et à un dysfonctionnement des réseaux neuronaux qui conduit aux troubles de la mémoire et du raisonnement observés dans la maladie d’Alzheimer.
Les nanocorps anti-tau, une nouvelle piste thérapeutique
Dans un article publié dans la revue Nature Communications, des scientifiques ont analysé une série de nanocorps anti-tau. Les nanocorps sont de petits anticorps artificiels, issus d’anticorps particuliers de camélidés. Ils se lient à différentes régions de la protéine tau avec des niveaux d’efficacité variés. Le but est de bloquer l'internalisation neuronale des formes monomériques et fibrillaires (pathologiques) de tau, une étape critique dans le mécanisme de propagation de type prion de tau. Ce criblage a permis d'identifier les nanocorps appelés A31, Z70 et H3-2 comme étant les inhibiteurs les plus puissants de l'internalisation cellulaire de la protéine tau monomérique dans les cultures de cellules neuronales de souris.
Ces nanocorps peuvent entrer en compétition avec la liaison entre tau et un domaine du récepteur membranaire LRP1. Le récepteur LRP1 (pour Lipoprotein Receptor-related Protein1) est une protéine transmembranaire qui joue un rôle clé dans l’endocytose et le transport de diverses protéines dans la cellule. Ces résultats confirment le rôle majeur de ce récepteur dans le processus d'internalisation de tau monomérique. Il est intéressant de noter que le nanocorps H3-2, qui lie l’extrémité carboxy-terminale de la protéine tau, est le meilleur inhibiteur de l’internalisation de tau, à la fois sous forme monomérique et fibrillaire, et le concurrent le plus puissant pour la liaison à LRP1. La capacité d’inhibition de l’internalisation des fibrilles de tau par le nanocorps H3-2 provient de sa capacité additionnelle à limiter l’interaction de tau avec des glycoprotéines présentes à la surface des cellules, les héparanes sulfates protéoglycanes (HSPGs). Ces résultats confirment que les voies d’internalisation de la protéine tau normale et fibrillaire dans les cellules neuronales sont bien distinctes.
En utilisant une combinaison de méthodes biophysiques, les scientifiques ont montré que le nanocorps H3-2 forme un dimère dont les deux sous-unités sont imbriquées, chacune se liant à son site de reconnaissance à l’extrémité de la protéine tau. Ce mode de liaison très original peut expliquer la puissante activité d'inhibition de l’internalisation cellulaire de la protéine tau par le nanocorps H3-2.
Ainsi, cette série de nanocorps représente une opportunité d’explorer plus avant les mécanismes d'intérêt pour cibler la propagation de tau, qui sont des paramètres critiques pour concevoir la meilleure approche d’une biothérapie ciblant tau. En effet, les anticorps thérapeutiques peuvent avoir des modes d'action différents, comme en témoigne leur efficacité individuelle dans les essais cliniques chez l'homme. À ce jour, plusieurs essais cliniques d'immunothérapies anti-tau (phase II ou III) ont été interrompus en raison d’une absence d'engagement de la cible ou d'efficacité. La biothérapie anti-tau nécessite donc le soutien de la recherche fondamentale et du développement pour être correctement conçue et peut bénéficier de l'utilisation des nanocorps se liant à la protéine tau pour atteindre cet objectif.
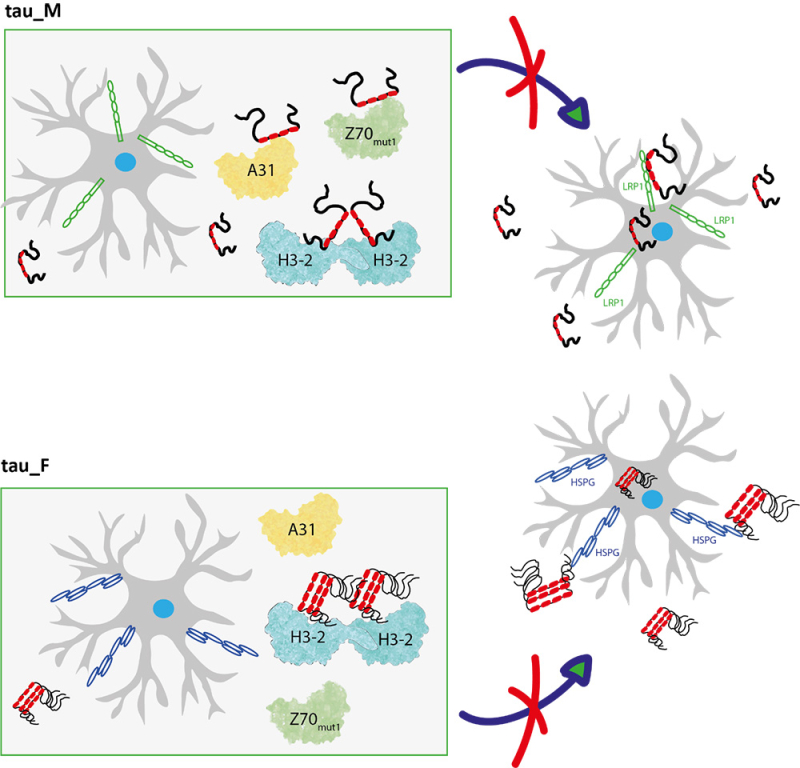
Figure : Les protéines tau sont internalisées dans les neurones sous forme monomérique (tau_M) et fibrillaire (pathologique, tau_F), une étape critique dans le mécanisme de propagation de type prion de tau. Cette internalisation est médiée par des récepteurs à la surface des neurones (en bleu HSPG et en vert LRP1). Les nanocorps Z70mut1 (vert), A31 (jaune) et H3-2 (bleu) sont capables de compétition avec le récepteur LRP1 pour la liaison à tau, bloquant ainsi son internalisation. Seul le nanocorps H3-2 est capable de diminuer l’internalisation des fibres de tau, qui dépend de la présence des récepteurs HSPG.
Référence : Inhibition of tau neuronal internalization using anti-tau single domain antibodies. Clément Danis, Elian Dupré, Thomas Bouillet, Marine Denéchaud, Camille Lefebvre, Marine Nguyen, Justine Mortelecque, François-Xavier Cantrelle, Jean-Christophe Rain, Xavier Hanoulle, Morvane Colin, Luc Buée & Isabelle Landrieu.
Nature Communications, 2 avril 2025, DOI : https://doi-org/10.1038/s41467-025-58383-4
Contact
Laboratoire
Lille Neuroscience & cognition - LilNcog (Inserm/Université de Lille)
Bâtiment Biserte,
Rue Polonovski
59045 Lille, France
Biologie structurale intégrative – BSI (CNRS/Inserm/Institut Pasteur de Lille/Université de Lille)
RID-AGE Risk factors and molecular determinants of ageing related diseases
Campus CNRS de la Haute Borne,
50 Avenue de Halley,
59658 Villeneuve d’Ascq