Comment tuer le parasite de la malaria (paludisme) en le rendant obèse ?
La malaria est causée par un parasite qui doit envahir le globule rouge humain pour s’y développer et se reproduire. Sa survie dépend du contrôle des ressources lipidiques détournées depuis l’hôte humain. Pour y parvenir, le parasite déploie un arsenal moléculaire qui lui permet de découper les lipides de l’hôte. Dans une étude publié dans la revue Cell Reports, les scientifiques ont réussi à identifier l’enzyme responsable de ce mécanisme ainsi que des molécules candidats médicaments permettant de bloquer ce processus et tuer le parasite.
Le parasite du paludisme ou malaria appartient au groupe des Apicomplexa, organismes unicellulaires, responsables de maladies infectieuses majeures chez l’homme et le bétail (toxoplasmose, cryptosporidiose…). La malaria est causée par la piqure du moustique Anophèle, lui-même infecté par le parasite Apicomplexa appelé Plasmodium. Chaque année, celui-ci infecte plusieurs centaines de millions de personnes et cause la mort de plus d’un demi million d’entre elles, pour la plupart des personnes âgées et des enfants. Il sévit essentiellement en Afrique Sub-Saharienne et en Asie du Sud-Est, principaux biotopes du moustique vecteur. La malaria est l’une des maladies infectieuses ayant les plus fortes conséquences humaines et sociales. Or, il n’existe à ce jour pas de vaccin efficace. De plus, l’émergence rapide de souches parasitaires résistantes aux traitements actuels (atermisinine, et chloroquine), soulignent l’urgence à développer de nouveaux traitements. L’éradication de la malaria constitue une des priorités mondiales d’autant que la propagation et la mortalité de la maladie se sont fortement aggravées dans le contexte de la crise sanitaire suite au Covid-19 et du réchauffement climatique. Le développement de nouvelles approches thérapeutiques passe par une meilleure connaissance des interactions entre le parasite et son hôte. C’est en effet ces interactions qui permettent la survie du parasite chez l’hôte.
Les Apicomplexa sont des parasites intracellulaires obligatoires qui doivent envahir une cellule humaine pour survivre et s’y propager. C’est le cas pour Plasmodium qui envahit les globules rouges humains et cause la malaria. Les parasites dépendent des cellules humaines et de leur environnement pour obtenir les nutriments nécessaires à leur division au sein du globule rouge. Des études récentes ont mis en évidence que les lipides de l’hôte sont au centre de la convoitise du parasite car ils lui permettent notamment de fabriquer les membranes des futurs parasites en division. Mais comment y parvient-il ? Quels sont les outils moléculaires que le parasite utilise et peut-on les bloquer pour tuer le parasite ?
Dans cette article, les scientifiques viennent d’identifier un des acteurs principal du processus infectieux : une protéine parasitaire appelée lysophospholipase (PfLPL3) que le parasite envoie au contact des membranes du globule rouge pour y « découper » les lipides détournés par le parasite puis les stocker et les utiliser au moment de sa division. De nouvelles approches d’analyses des flux lipidiques par spectrométrie de masse de microscopies de pointe ont mis en évidence que l’inactivation de cette enzyme induit une rapide dérégulation du métabolisme lipidique du parasite et sa mort. Celui-ci ne peut plus correctement gérer l’afflux constant des lipides qu’il vole à l’hôte. En conséquence, il ne peut plus utiliser correctement les lipides du globule rouge pour s’y diviser et meurt alors par accumulation toxique de lipides (lipotoxicité) ou obésité.
Les scientifiques ont alors cherché d’éventuels inhibiteurs de cette enzyme qui pourraient ainsi tuer et donc théoriquement traiter les globules rouges infectés et permettrait le développement d’un nouveau traitement contre la malaria. Deux molécules bloquant spécifiquement la lysopholipase3 ont ainsi été identifiées. Celles-ci sont capables de tuer et éradiquer la présence parasite in vitro. Cette nouvelle étude a donc permis de valider ces molécules en tant que nouveaux candidats médicaments, mais également des outils pour la recherche sur la malaria. Ceux-ci sont actuellement en cours de développement.
Ces avancées pourraient permettre de faire progresser la lutte contre la malaria et en faire bénéficier les nombreux malades qui en souffrent.
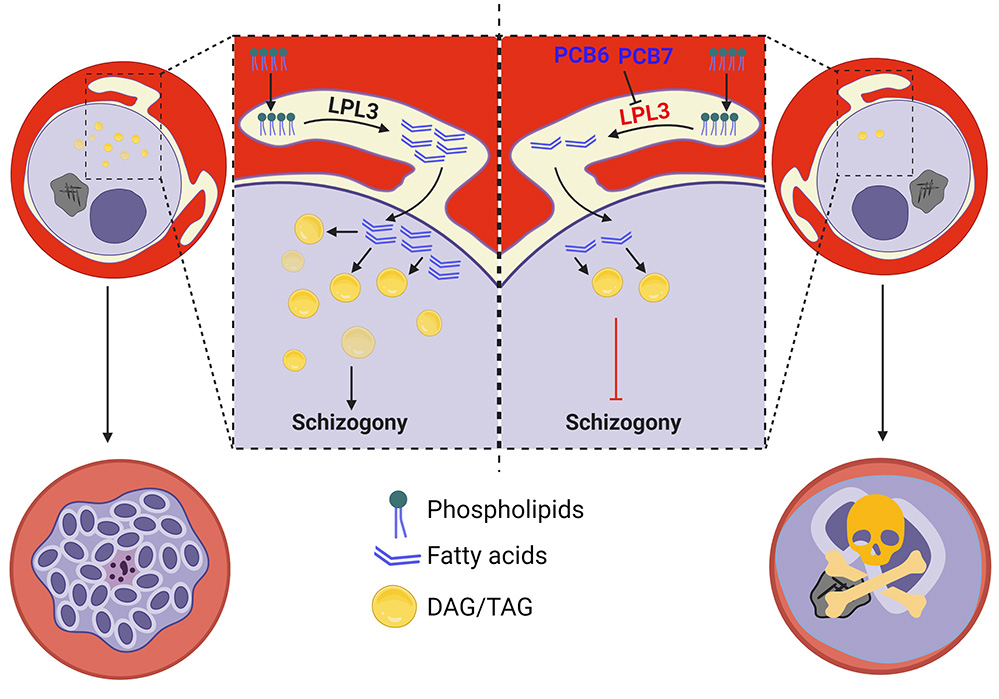
Figure : Rôle de la proteine Lysophospholipase3 (LPL3) chez l’agent de la malaria humaine, Plasmodium falciparum. (Panneau de gauche) : Une fois à l’intérieur du globule rouge humain, le parasite modifie la structure de l’hôte. Elle y envoie la protéine à l’interface hôte-parasite où LPL3 « digère » les lipides de l’hôte (Phospholipids) pour générer des acides gras (fatty acids). Ceux-ci sont ensuite stockés sous forme de lipides neutres de stockage (DAG,TAG) et mobilisés uniquement lors de la division parasitaire (schizogony) afin de permettre la propagation et la survie du parasite. (Panneau de droite) : Sans la protéine LPL3 ou après traitement avec les candidats-médicaments (PCB6 PCB7), le parasite n’est plus capable de digérer et stocker les lipides de l’hôte. Il n’est plus capable de fabriquer le matériel membranaire nécessaire pour sa division et meurt.
Pour en savoir plus :
A Plasmodium falciparum lysophospholipase regulates host fatty acid flux throughvia parasite lipid storage to enable controlled asexual schizogony.
Sheokand PK, Yamaryo-Botté Y, Narwal M, Arnold CS, Thakur V, Islam Banday MM, Asad M, Botté CY*, Mohmmed A*.
Cell Reports 2023 Mar 30:112251. DOI:https://doi.org/10.1016/j.celrep.2023.112251
Contact
Laboratoire
Institut pour l’avancée des biosciences (CNRS/Inserm/Université Grenoble Alpes)
Equipe Apicolipid
IAB CNRS UMR5309
Bat. Jean Roget, Domaine de la Merci
38700 La Tronche