Comment Mycobacterium tuberculosis joue à cache-cache avec le système immunitaire
Pour assurer une colonisation efficace et survivre au sein de leur organisme hôte, la plupart des agents pathogènes ont élaboré des stratégies permettant d'atténuer la réponse immunitaire développée lors de l'infection. Les travaux des chercheurs de l’Institut de pharmacologie et de biologie structurale, réalisés en collaboration avec le Centre d'infection et d'immunité de Lille, les Instituts Pasteur de Corée et de Paris, et la société InvivoGen, permettent de comprendre les mécanismes moléculaires mis en place par la bactérie responsable de la tuberculose pour tromper le système immunitaire. Cette compréhension est cruciale pour développer des moyens de lutte appropriés contre ce redoutable pathogène. L’étude a été publiée le 2 octobre 2017 dans la revue PNAS.
Mycobacterium tuberculosis, agent de la tuberculose humaine, est une bactérie capable d’inhiber la fonction des macrophages, cellules du système immunitaire inné dont le rôle est de reconnaitre et de tuer les microorganismes infectieux. Au cours de cette étude, les chercheurs ont utilisé une collection de mutants de M. tuberculosis pour infecter des macrophages et décrypter les mécanismes par lesquels ce pathogène module leur fonction.
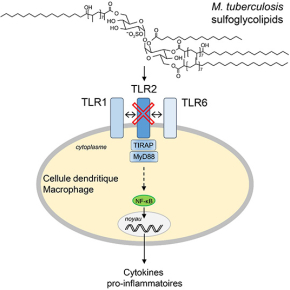
En analysant des mutants ayant perdu la capacité à perturber la fonction des macrophages, ils ont découvert que M. tuberculosis produit des glycolipides à la surface de son enveloppe, appelés sulfoglycolipides, qui agissent comme antagonistes d’un récepteur macrophagique du système immunitaire inné, dénommé TLR2. Ce récepteur dédié à la détection des pathogènes et à l’initiation de la réponse inflammatoire reconnait, en hétérodimère avec les récepteurs TLR1 ou TLR6, les lipoprotéines bactériennes. Les sulfoglycolipides en bloquant le site de liaison du récepteur freinent le déclenchement de la voie de signalisation associée à ce dernier. Ainsi, M. tuberculosis inhibe l’activation de NF-κB, un facteur de transcription central de la réponse immunitaire innée, la production de cytokines pro-inflammatoires et l’expression de molécules de co-stimulation impliquées dans la communication entre les macrophages et les lymphocytes. Ce faisant, M. tuberculosis empêche une stimulation efficace du système immunitaire et peut alors se développer plus facilement au sein de l’organisme.
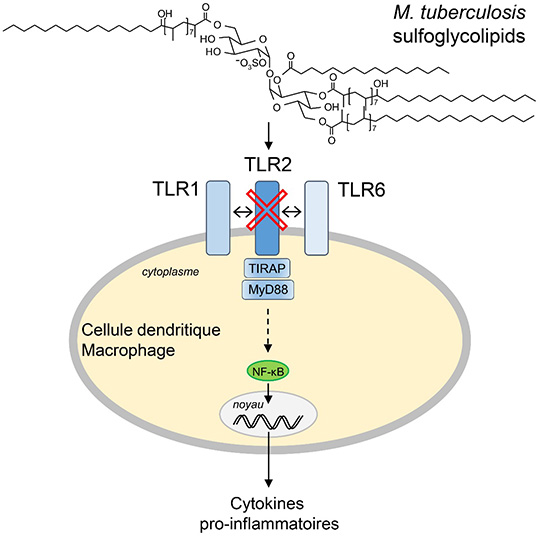
©Jérôme Nigou & Martine Gilleron
En savoir plus
-
Mycobacterium tuberculosis inhibits human innate immune responses via the production of TLR2 antagonist glycolipids.
Landry Blanc, Martine Gilleron, Jacques Prandi, Ok-ryul Song, Mi-Seon Jang, Brigitte Gicquel, Daniel Drocourt, Olivier Neyrolles, Priscille Brodin, Gérard Tiraby, Alain Vercellone, and Jérôme Nigou.
PNAS. Early Edition 03.10.2017. doi: 10.1073/pnas.1707840114