Comment l’ovocyte devient gamète ?
Pour devenir un gamète, l’ovocyte doit sortir d’un état de quiescence au cours duquel il accumule des réserves pour l’embryon et effectuer deux divisions, dites méiotiques. Cette décision dépend de deux enzymes : la kinase PKA qui arrête la division, et la kinase Cdk1 qui la déclenche. Dans un article publié dans le journal Cell Reports, les scientifiques décryptent comment se fait la bascule entre PKA et Cdk1 qui permet à l’ovocyte de se transformer en gamète.
Pour se transformer en gamètes, les cellules reproductrices doivent effectuer deux divisions, dites méiotiques, qui réduisent de moitié leur contenu génétique. Chez les femelles, les ovocytes subissent une interruption prolongée, durant des mois voire des années chez les vertébrés, en début de première division méiotique. Lors de cet arrêt, ils accumulent les composants nécessaires pour le développement de l'embryon, ce qui correspond à une augmentation spectaculaire de leur taille. Au moment de l'ovulation, les ovocytes reprennent la division interrompue et deviennent des gamètes aptes à être fécondés.
Les protéines PKA et Cdk1 impliquées dans le réveil de l’ovocyte
Pour comprendre ce parcours intrigant qu’est le développement de l'ovocyte, les scientifiques se sont concentrés sur la bascule de son état dormant à un état actif de reprise de la division en utilisant l'ovocyte d’un amphibien : le xénope. Les ovocytes de cet animal représentent un excellent modèle pour étudier la division cellulaire en raison de leur taille exceptionnelle (plus de 1 mm) qui permet l'injection de protéines et d'ARNm de façon à affecter les processus qui se déroulent pendant cette phase critique du développement de l'ovocyte. De plus, une tache blanche se forme au pôle de l’hémisphère pigmenté de l’ovocyte dès que ce dernier entre en division, ce qui permet un suivi facile et précis du processus. Chez les vertébrés, la décision de l'ovocyte de maintenir son arrêt ou au contraire de reprendre la division cellulaire est déterminée par une séquence d'événements impliquant deux protéines-clés : PKA et Cdk1. PKA est l’acteur majeur de l'arrêt de la division ; à l’opposé, Cdk1 est l’inducteur incontournable de la division cellulaire. Ainsi, la forte activité de PKA permet l’arrêt de l’ovocyte en inhibant Cdk1. Inversement, au moment de l’ovulation, une hormone, la progestérone dans le cas du Xénope, provoque l’inhibition de PKA et cette inhibition déclenche l'activation de Cdk1, et donc la reprise de la division. Mais on ignorait quels étaient les connexions moléculaires reliant ces deux protéines. Elles doivent être multiples car il faut 3 à 4 heures pour que la baisse de PKA conduise à la hausse de Cdk1.
Des cascades moléculaires méconnues relient les protéines PKA et Cdk1
Les scientifiques ont injecté une protéine inhibitrice de Cdk1, appelée Cip1. Ils ont ensuite ajouté l’hormone, ce qui inhibe PKA. Mais dans ces conditions, Cdk1 ne peut pas être activé. Ce protocole permet d’identifier les évènements déclenchés par l’inhibition de PKA et qui se produisent en amont de Cdk1. On peut ainsi disséquer les étapes se déroulant au cours du processus dicté par l’inactivation de PKA, sans avoir d’interférence avec des boucles de rétroaction émises par Cdk1. Ils ont ainsi découvert que plusieurs cascades moléculaires relient l'inactivation de la PKA à l'activation de Cdk1, assurant un choix cellulaire irréversible entre arrêt ou reprise de la division. Deux protéines clés sont au cœur de cette décision : la cycline B1 et la kinase Mos, deux activateurs de Cdk1. L’inhibition de PKA lance l’accumulation de la cycline B1 par un mécanisme inattendu : ce n’est pas sa fabrication qui est stimulée, mais sa destruction qui est stoppée. C’est l’inverse qui se produit pour Mos, dont la fabrication est stimulée, mais dont la destruction reste très active. Conséquence : Mos ne peut s’accumuler, au contraire de la cycline B1 qui active ainsi Cdk1. Mos ne sera stabilisé, et donc accumulé, que dans un second temps. Enfin, les scientifiques ont découvert que l’un des seuls substrats connus de PKA dans l’ovocyte, la protéine Arpp19, ne contrôlait ni Mos ni la cycline B1. PKA a donc d’autres cibles, totalement inconnues, qui lui permettent d’agir sur la cycline B1 et Mos, des acteurs-clés qui restent encore à découvrir ! Cette étude dévoile les coulisses moléculaires de ce qui se joue pour permettre aux ovocytes de passer de la dormance à la fécondation. L’étude de ces processus permet non seulement de comprendre comment est prise la décision des cellules de se diviser, mais d’ouvrir également des pistes prometteuses pour l'avancement des technologies de procréation assistée et des traitements de la fertilité.
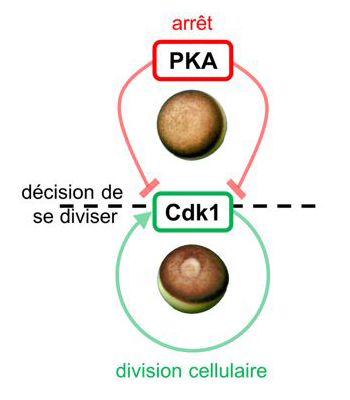
Figure : Dans l’ovaire, la cellule reproductrice femelle, l’ovocyte, est arrêtée au début de la première division de méiose. Chez tous les vertébrés, cet arrêt est maintenu par l’activité de la kinase PKA. En effet, celle-ci inhibe une autre kinase Cdk1, qui déclenche et orchestre la division des cellules. Au moment de l’ovulation, une stimulation hormonale inactive PKA. Cdk1 n’est plus inhibée et provoque la reprise de la division.
En savoir plus :
Santoni M, Meneau F, Sekhsoukh N, Castella S, Le T, Miot M, Daldello EM. Unraveling the interplay between PKA inhibition and Cdk1 activation during oocyte meiotic maturation. Cell Rep. 2024 Feb 13;43(2):113782. doi: 10.1016/j.celrep.2024.113782.
Contact
Laboratoire
Laboratoire de biologie du développement - LBD (CNRS/Sorbonne Université)
9 Quai Saint-Bernard,
75005 Paris
