Comment les protéines rivales de la nucléation de l’actine apprennent à coopérer
Dans les cellules, l’actine s’assemble en filaments organisés selon des architectures variées, pour accomplir diverses tâches essentielles. Selon qu’ils sont générés par les formines ou par Arp2/3, les filaments sont organisés en long faisceaux parallèles, ou forment au contraire des arborescences très ramifiés. Une étude parue dans la revue Nature Cell Biology, combinant approches cellulaires et in vitro, montre que ces deux nucléateurs antinomiques coopèrent, grâce à la protéine SPIN90 qui les associe dans un complexe pour générer efficacement de longs filaments. Cela amène à repenser la compétition entre les nucléateurs de l’actine.
L'actine, une des protéines les plus abondantes chez les eucaryotes, est un élément clé du cytosquelette et est essentielle à la plupart des processus cellulaires. Les réseaux de filaments d'actine se présentent sous différentes architectures, avec deux archétypes principaux : les faisceaux de longs filaments linéaires, qui sont rapidement assemblés par les formines ; et les réseaux de filaments branchés, qui résultent de l'initiation de nouveaux filaments par le complexe Arp2/3, liés aux côtés des filaments existants. Les formines et le complexe Arp2/3 sont souvent considérés comme les deux principaux générateurs de filaments d'actine dans les cellules, et la compréhension de leur compétition est une question clé. Le cortex cellulaire, qui est un réseau dense de filaments d'actine générés à la fois par les formines et par le complexe Arp2/3, fournit un contexte pertinent pour étudier comment leur compétition est régulée.
Dans le cadre d'une collaboration avec l'University College London, les scientifiques ont identifié les principaux activateurs des formines et du complexe Arp2/3 dans le cortex cellulaire. Parmi eux, la protéine SPIN90 était particulièrement intéressante, puisqu'il a été récemment démontré qu'elle est capable d'activer Arp2/3 pour générer un nouveau filament, sans former une branche à partir d'un filament existant. Au niveau du cortex cellulaire, SPIN90 semblait agir comme un activateur des formines, alors que les études biochimiques précédentes n'ont pas montré une telle activation.
Pour résoudre cette contradiction apparente, les chercheurs ont réalisé une série d'expériences de biochimie et de biophysique in vitro, et notamment des expériences de microscopie assistée par microfluidique où ils ont observé des filaments d'actine et des molécules individuelles. Ils ont découvert que SPIN90 pouvait former un complexe ternaire avec Arp2/3 et la formine, ce qui permet de nucléer efficacement des filaments en croissance rapide, avec SPIN90-Arp2/3 à une extrémité et la formine à l'autre. La première micrographie électronique à coloration négative du complexe ternaire SPIN90-Arp2/3-formine a été obtenue.
Ce travail montre que les deux principaux nucléateurs des filaments d'actine, considérés comme agissant en concurrence, peuvent en fait être amenés à travailler ensemble. En réalisant cela, SPIN90 combine le fort pouvoir de nucléation d’Arp2/3 avec la capacité de la formine à allonger rapidement les filaments. Ce nouveau mécanisme moléculaire explique comment SPIN90 peut réguler l'architecture et les propriétés mécaniques du cortex cellulaire- et est susceptible de contribuer à la régulation d'autres réseaux de filaments d'actine dans les cellules.
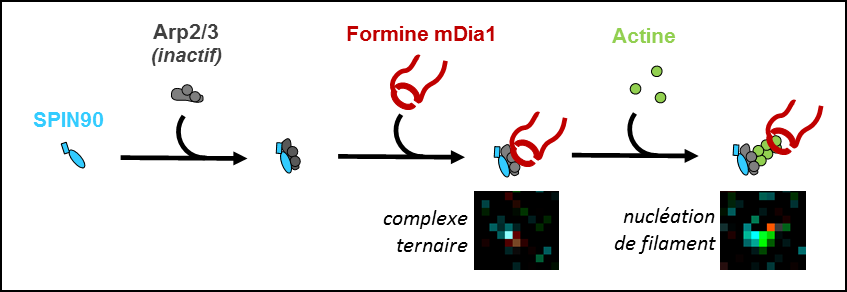
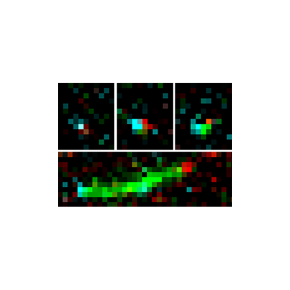
Figure : La protéine SPIN90 se lie au complexe Arp2/3 et l’active. Un formine se lie au complexe Arp2/3 ainsi activé, formant un complexe ternaire qui nuclée rapidement un filament d’actine. Le filament s’allonge ensuite rapidement par l’extrémité où réside la formine, tandis que l’autre reste liée à SPIN90-Arp2/3. Images de microscopie de fluoresence, in vitro, à partir de protéines purifiées : l’actine est marquée en vert, SPIN90 en bleu, et la formine en rouge (Arp2/3 n’est pas marqué).
Pour en savoir plus:
SPIN90 associates with mDia1 and the Arp2/3 complex to regulate cortical actin organization.
Cao L, Yonis A, Vaghela M, Barriga EH, Chugh P, Smith MB, Maufront J, Lavoie G, Méant A, Ferber E, Bovellan M, Alberts A, Bertin A, Mayor R, Paluch EK, Roux PP, Jégou A, Romet-Lemonne G, Charras G.
Nat Cell Biol. 22 June 2020 . doi: 10.1038/s41556-020-0531-y.
Contact
Laboratoire
Institut Jacques Monod (IJM) - (CNRS/ Université de Paris)
15 rue Hélène Brion 75013 Paris