Comment les cellules se déplacent-elles à force totale nulle ?
Les cellules individuelles se déplacent in vivo dans des environnement 3D complexes. Si les mécanismes biologiques impliqués sont bien connus, les principes physiques restent encore incompris. En particulier, le mouvement se produit à force nulle, et nécessite une brisure de symétrie dont l’origine est souvent obscure. Cette étude, à l’interface entre la physique et la biologie, montre que la synchronisation entre dipôles de forces de part et d’autre du noyau permet l’avancée des cellules dans une ‘forêt’ de fibres. Ces résultats sont publiés dans la revue eLife.
Tout mouvement nécessite une brisure de symétrie. Dans le monde microscopique où l’inertie ne joue pas de rôle, cette asymétrie doit être permanente. Purcell a proposé dans un article de 1977 des règles incontournables qui régissent le mouvement des micro-nageurs. Comment ce principe fondamental peut être étendu à des cellules en mouvement dans des matrices est cependant peu compris en biologie cellulaire.
Les scientifiques montrent l’origine de la brisure de symétrie. Ils ont placé des cellules individuelles dans une matrice 3D proches des matrices physiologiques et ont suivi les acteurs majeurs de déplacement, les contacts focaux, les cytosquelettes d’acto-myosine, les microtubules, en corrélation avec les déplacements de la matrice extracellulaire. Leurs résultats indiquent que les cellules se contractent de part et d’autre du noyau et la synchronisation entre contractions entraîne le mouvement.
Pour aller plus loin dans l’analyse, les scientifiques ont caractérisé le mouvement directionnel dans un espace représentant la distribution spatiale de la déformation de la matrice autour de la cellule par un développement multipolaire, le diagramme dipôle-quadrupôle. S’il présente une aire finie, la cellule avance. Cette représentation peu commune permet d’avoir un tableau de bord robuste pour caractériser le mouvement cellulaire. On peut même contrôler le déplacement cellulaire en induisant des dipôles localement par un laser.
Cette étude aux interfaces entre la biologie et la physique ouvre des perspectives originales pour la compréhension des déplacements cellulaires dans des contextes physiologiques, mais aussi dans des situations pathologiques comme les métastases durant lesquelles les cellules migrent de manière incontrôlée.
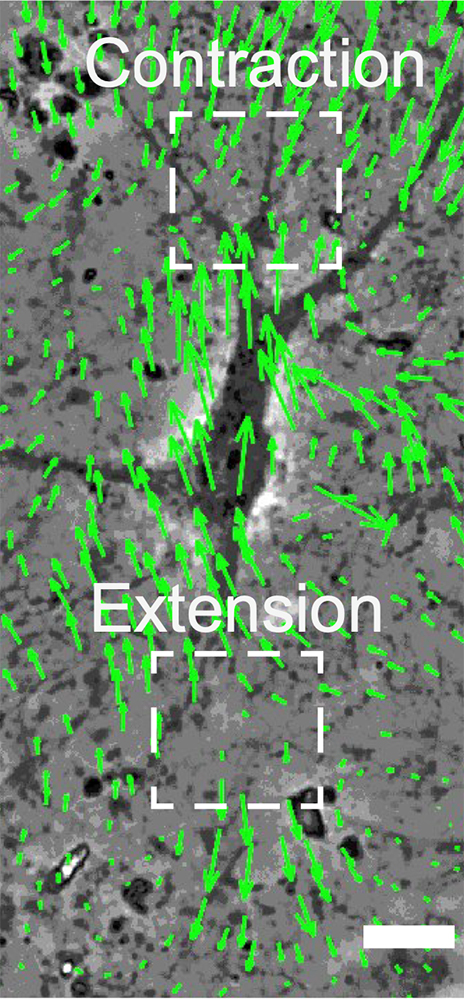
Figure : La cellule se déplace dans une matrice 3D qui se déforme à son passage. Les contractions et extensions locales sont représentées par les vecteurs. Échelle 10 µm.
Pour en savoir plus :
3D single cell migration driven by temporal correlation between oscillating force dipoles.
Godeau AL, Leoni M, Comelles J, Guyomar T, Lieb M, Delanoë-Ayari H, Ott A, Harlepp S, Sens P, Riveline D.
Elife. 28 juillet 2022doi: 10.7554/eLife.71032.
Contact
Laboratoires
Institut de génétique, biologie moléculaire et cellulaire - IGBMC (CNRS/Université de Strasbourg/Inserm)
1 Rue Laurent Fries,
BP 10142,
67400 Illkirch
Laboratoire Physico-Chimie Curie (CNRS/Institut Curie/Sorbonne Université)
Institut Curie
11 rue Pierre et Marie Curie,
75231 PARIS