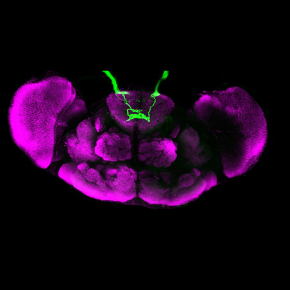
Comment les bactéries modifient-elles le comportement des drosophiles ?
Confrontés aux microorganismes qui partagent leur environnement, les eucaryotes disposent de mécanismes pour les contenir. Lorsque cette barrière immunitaire est franchie et que l’animal est infecté, d’autres processus biologiques sont déclenchés qui limitent les conséquences de l’infection. Dans une étude publiée dans la revue eLife, les chercheurs montrent que des femelles drosophiles infectées par des bactéries pondent moins d’œufs que les femelles saines. Ils apportent la preuve que cette adaptation comportementale est due à la détection directe d’un composé universel présent dans la paroi bactérienne, appelé peptidoglycane, par seulement quelques neurones présents dans le cerveau des mouches.
Quiconque a été victime d'une infection virale ou bactérienne connaît les effets secondaires qui se traduisent par une perte de l’appétit, un sommeil fragmenté et, dans les cas extrêmes, un état dépressif. Si ces "effets secondaires" qui reflètent l’impact des microorganismes sur le système nerveux de l’hôte ont été clairement établis, la nature des molécules microbiennes vecteurs de l’effet et l’identité précise des neurones ciblés demeurent, dans la plupart des cas, inconnus.
Les chercheurs avaient montré dans une étude précédente que le comportement de ponte des drosophiles infectées par des bactéries était modifié, les femelles infectées pondant moins d’œufs que leurs congénères saines. Ce travail apportait la preuve que la détection d’un composant majeur et universel de la paroi bactérienne, le peptidoglycane, par les neurones des drosophiles infectées altérait leur comportement. L’étape suivante était d’identifier précisément ces neurones et de démontrer comment ce composé bactérien pouvait modifier leur activité.
Dans cette nouvelle publication, les chercheurs utilisent la puissance des outils génétiques et moléculaires disponibles chez la drosophile pour démontrer qu’en agissant sur uniquement un ou deux neurones, parmi les 100 000 que contient le cerveau de drosophile, le composé bactérien altère le comportement de l’hôte. En utilisant l’imagerie calcique qui permet de mesurer la concentration calcique intracellulaire, les auteurs démontrent que l’application directe du peptidoglycane bactérien in vivo ou ex vivo suffit à bloquer l’activité de ces neurones. Il reste à comprendre les mécanismes par lesquels la détection du peptidoglycane et l’activation de la voie de signalisation NF-kB bloquent leur activité. Les mécanismes cellulaires qui permettent au peptidoglycane d’atteindre ces neurones en franchissant la barrière hématoencéphalique restent également à élucider.
Se pose maintenant la question de la généralisation de ces découvertes aux vertébrés. Plusieurs éléments laissent penser que le mécanisme pourrait être conservé au-delà des invertébrés. D’une part, le peptidoglycane produit par les bactéries du microbiote des souris a été détecté dans la circulation sanguine et est capable de franchir la barrière hémato-encéphalique. Par ailleurs, des souris mutantes pour des récepteurs du peptidoglycane présentent des troubles du comportement et des interactions sociales. Le travail récemment publié ajoute une pièce importante au puzzle complexe qui régit les interactions entre le monde microbien et le système nerveux des eucaryotes.
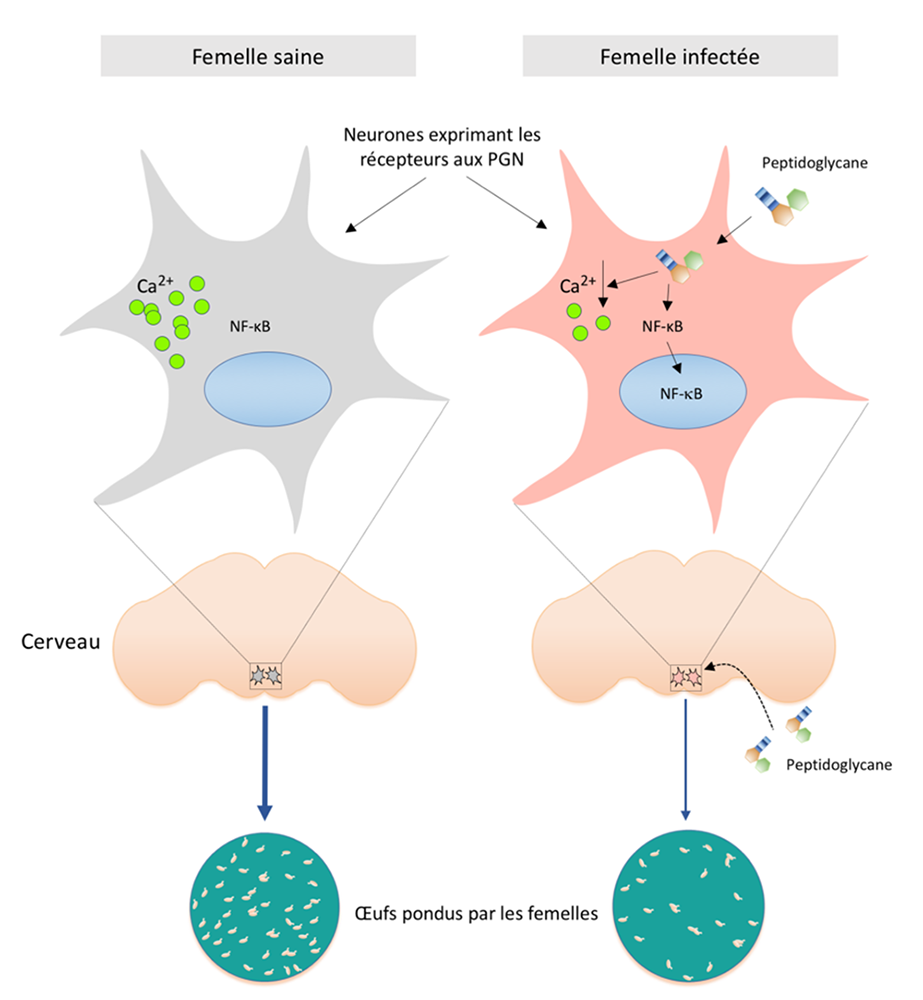
Figure : (À gauche) : En l’absence d’infection, les drosophiles femelles fécondées pondent des œufs. (À droite) : Lors d’une infection, les bactéries qui prolifèrent produisent dans le milieu extracellulaire des fragments de peptidoglycane, un composant de leur paroi. Par des mécanismes inconnus, ce composé de la paroi bactérienne pénètre dans le cerveau. Sa détection par seulement un ou deux neurones (encadrés), sur les quelques 100 000 que contient le cerveau d’une drosophile, provoque leur inhibition (baisse de taux de calcium) et, in fine, un ralentissement de la ponte. Il est probable que cette baisse de ponte permette à la drosophile infectée d’allouer un maximum d’énergie à la lutte contre l’infection. Une fois l’infection contrôlée, le niveau de ponte revient à la normal. Il s’agit d’un cas d’immunité comportementale.
Pour en savoir plus :
Peptidoglycan-dependent NF-κB activation in a small subset of brain octopaminergic neurons controls female oviposition.
Masuzzo A, Manière G, Viallat-Lieutaud A, Avazeri É, Zugasti O, Grosjean Y, Kurz CL, Royet J.
Elife. 2019 Oct 29;8. pii: e50559. doi: 10.7554/eLife.50559.