Comment le bacille de la tuberculose a appris à respirer en absence d’oxygène
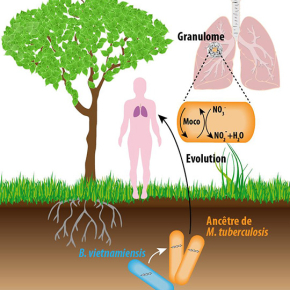
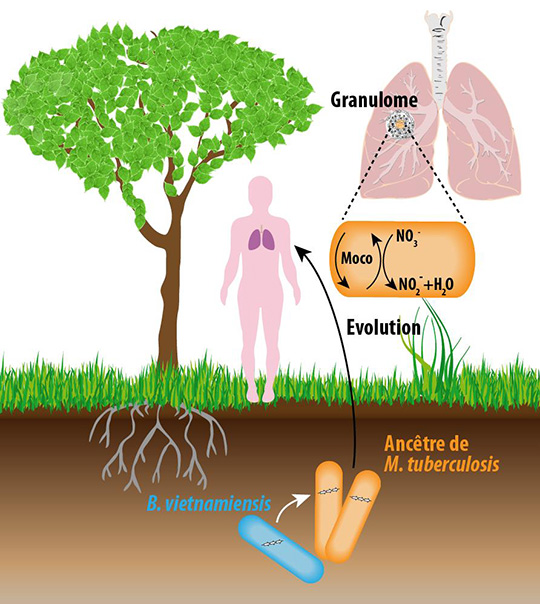
Le bacille de la tuberculose, Mycobacterium tuberculosis, peut persister pendant des décennies dans les poumons des individus infectés avant qu’il ne se réactive et déclenche la maladie. Cette étape « dormante » de la vie du bacille se déroule dans un environnement très pauvre en oxygène : le granulome. Des chercheurs de l’Institut de pharmacologie et de biologie structurale ont découvert que cette capacité à survivre en absence d’oxygène a été acquise grâce à un événement de transfert horizontal de gènes depuis des bactéries du sol vers l’ancêtre de M. tuberculosis, quand celui-ci vivait dans l’environnement. Ces résultats publiés le 27 novembre 2017 dans la revue PLOS Pathogens, portent un éclairage nouveau sur la compréhension de l’évolution de M. tuberculosisdepuis une bactérie environnementale vers le pathogène le plus meurtrier chez l’homme qu’il est devenu aujourd’hui.
La tuberculose est encore selon l’Organisation Mondiale de la Santé la maladie infectieuse la plus meurtrière, avec plus de 10 millions de nouveaux cas et 1,7 millions de décès en 2016.
Une des propriétés les plus intrigantes et méconnues du bacille de la tuberculose, Mycobacterium tuberculosis, est sa capacité à persister pendant des années et jusqu’à des décennies dans les poumons des individus contaminés. Cette période dite de « dormance » dans le cycle infectieux du bacille se déroule dans des lésions pulmonaires caractéristiques de la maladie appelées « granulomes ». Les granulomes étant des structures très pauvres en oxygène, M. tuberculosis dispose de mécanismes alternatifs de respiration.
La respiration telle qu’on l’entend communément consiste en une chaîne de réactions d’oxydo-réduction dans laquelle l’accepteur final d’électrons est le dioxygène (O2), qui est alors réduit en eau (H2O). En absence d’oxygène, certaines bactéries ont la possibilité d’utiliser d’autres accepteurs finaux d’électrons. Dans le cas de M. tuberculosis, la bactérie utilise les nitrates (NO3-) qu’elle réduit en nitrites (NO2-), des molécules toxiques qui sont ensuite soit rejetées à l’extérieur de la bactérie, soit transformées en ammoniac. Cette réduction des nitrates en nitrites s’effectue grâce à une enzyme, la nitrate réductase. Pour fonctionner, cette enzyme nécessite un cofacteur contenant du molybdène appelé Moco.
Les chercheurs ont montré que la capacité de M. tuberculosis à synthétiser rapidement Moco quand l’oxygène s’appauvrit repose sur un groupe de gènes acquis par un mécanisme dit de « transfert horizontal » par l’ancêtre du bacille à partir d’une bactérie du sol, Burkholderia vietnamiensis ou une bactérie proche de cette espèce. Si ces gènes sont absents (après délétion génétique), le bacille ne respire plus les nitrates et ne survit plus en absence d’oxygène in vitro et in vivo.
De façon surprenante, M. tuberculosis, comme toutes les mycobactéries, possède d’autres groupes de gènes possiblement impliqués dans la synthèse de Moco ; cependant, seule l’expression des gènes acquis horizontalement est rapidement induite lors d’un stress hypoxique de façon à démarrer immédiatement la synthèse de Moco.
Ces résultats confirment l’hypothèse communément admise que l’ancêtre de M. tuberculosis était probablement une bactérie environnementale, et identifient une étape cruciale dans l’évolution du bacille vers un pathogène humain dévastateur. Ils permettent également d’envisager de nouvelles approches thérapeutiques pour cibler les bacilles dormants en inhibant la synthèse de Moco.
© Françoise Viala
En savoir plus
-
Horizontal acquisition of a hypoxia-responsive molybdenum cofactor biosynthesis pathway contributed to Mycoium tuberculosbacteris pathoadaptation.
Levillain F, Poquet Y, Mallet L, Mazères S, Marceau M, Brosch R, Bange FC, Supply P, Magalon A, Neyrolles O.
PLoS Pathog. 2017 Nov 27;13(11):e1006752. doi: 10.1371/journal.ppat.1006752.