Caractérisation d’un acteur-clé de la résistance bactérienne
La médecine moderne est aujourd'hui confrontée à l’apparition de plus en plus fréquente de bactéries pathogènes résistantes aux traitements par antibiotiques. Les conséquences sont désastreuses pour la société et, plus particulièrement, pour les personnes infectées par ces bactéries. Dans un article publié dans la revue Structure, les scientifiques décrivent la structure tridimensionnelle de GacS, protéine-clé dans le développement de la résistance chez Pseudomonas æruginosa.
L'une des raisons majeures qui fait que ces bactéries résistantes brandissent un « bouclier » capable d'empêcher l’antibiothérapie d'agir, est leur capacité à vivre en communauté, au sein d’un biofilm* bactérien (*ensemble de bactéries enrobées dans une matrice composée d’ADN, de protéines et de polysaccharides).
Ces dernières décennies, Pseudomonas Aeruginosa (PA) a été désignée comme un agent pathogène majeur infectant les patients hospitalisés pour un cancer, la mucoviscidose ainsi que les grands brûlés. PA est capable de passer d’un mode de vie planctonique (en nage libre) — pendant lequel elle réalise une infection aiguë, et lors de laquelle l’éradication des bactéries est possible — à un mode de vie sédentaire (au sein du biofilm) pour l’infection chronique, résistant aux traitements antibiotiques de longue durée. L’infection chronique affecte plus de 80% des patients adultes atteints de mucoviscidose. Elle est la principale cause de morbidité et de mortalité.
Le système GacS/GacA : GacS est une histidine kinase (HK) qui reconnaît un signal environnemental. Elle transmet ensuite ce signal à l’intérieur de la bactérie. Ce processus sert à déclencher une réponse fonctionnelle en utilisant la protéine partenaire GacA. GacS est une protéine membranaire composée de sept sous-domaines fonctionnels. Elle est impliquée dans le développement du biofilm de PA. Mais, son action est régulée par d’autres protéines. En particulier, la protéine RetS qui interfère sur la signalisation de GacS, en interagissant directement avec elle. Cette action stoppe le développement du biofilm et favorise l’infection aiguë.
Ainsi, GacS et RetS représentent à eux deux un interrupteur moléculaire chez PA qui ferait passer d’un mode d’infection chronique à un palier aigü.
Les scientifiques ont établi la structure tridimensionnelle de 135Å de longueur, de 3 domaines cytoplasmiques de GacS, et mettent en évidence une nouvelle interface d’interaction entre GacS et RetS ainsi qu’un nouveau domaine essentiel pour l’activité de GacS mais dont la fonction reste inconnue.
Ces résultats permettent de connaitre plus intimement la fonction de cette HK majeure chez PA qui a toujours fait l’objet de beaucoup d’attention de la part de la communauté scientifique de par son rôle stratégique, tel un chef d’orchestre, dans la phase précoce de développement du biofilm. Ils ouvrent un champ de recherche jusqu’à présent peu exploré par manque d’information à l’échelle moléculaire et qui pourrait permettre dans le futur le développement de molécules thérapeutiques capables de maitriser les modes d’infection de PA.
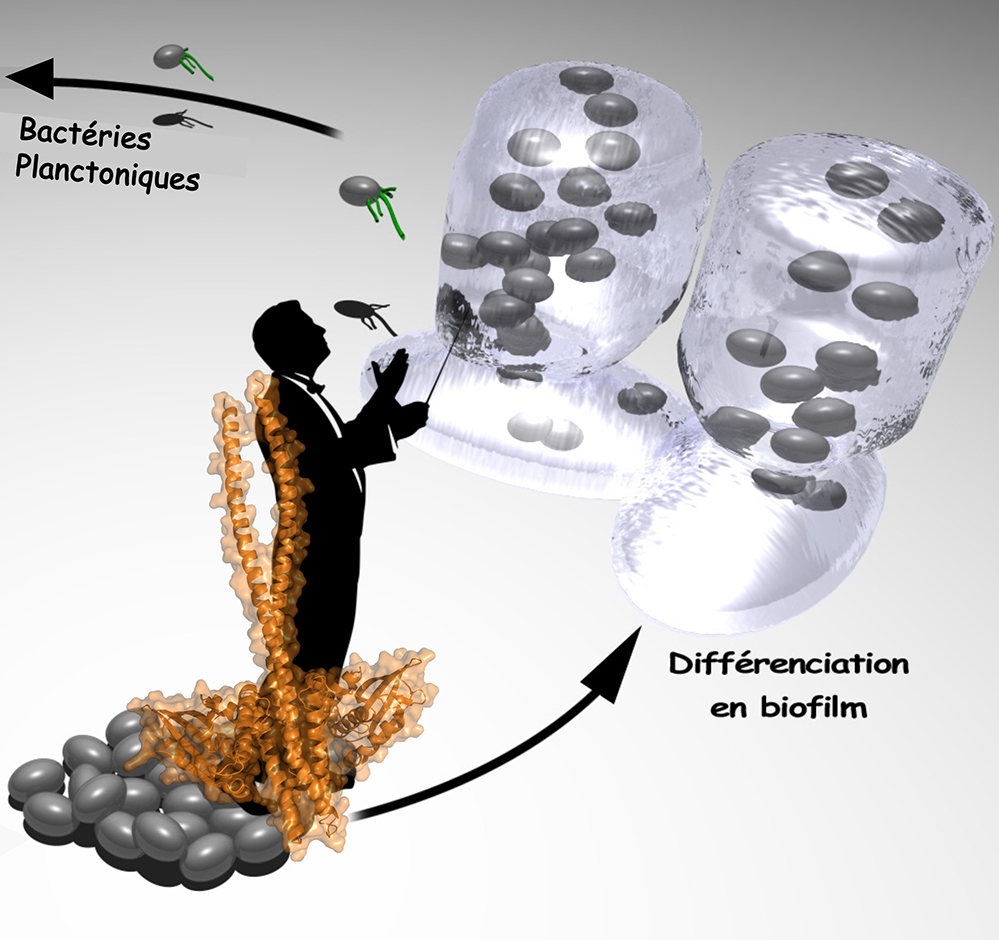
Figure : Illustration du rôle joué par GacS (Structure 3D résolue dans cette étude, montrée en orange) dans le développement du biofilm bactérien.
Pour en savoir plus :
Insights into the atypical autokinase activity of the Pseudomonas aeruginosa GacS histidine kinase and its interaction with RetS
Firas Fadel, Violla Bassim, Vanessa I. Francis, Steven L. Porter,Thomas Botzanowski, Pierre Legrand, Maria Maté Perez, Yves Bourne, Sarah Cianférani, Florence Vincent
Structure 28 juin 2022. DOI : https://doi.org/10.1016/j.str.2022.06.002
Contact
Laboratoire
Laboratoire Architecture et fonction des macromolécules biologiques - AFMB (CNRS/Université Aix-Marseille)
163 avenue de Luminy
Case 932
13288 Marseille cedex 09