Cancers : une nouvelle piste pour améliorer l’efficacité des immunothérapies
La migration des lymphocytes T détermine leur capacité à contrôler la croissance tumorale. Dans un article publié dans la revue Nature Communications, les scientifiques révèlent le rôle déterminant du métabolisme des mitochondries dans les déplacements des lymphocytes T à l’intérieur des tumeurs. Cette découverte permet d’envisager de nouvelles approches permettant d’augmenter l’efficacité des immunothérapies actuelles.
Dans de nombreuses tumeurs solides les lymphocytes T sont incapables de se déplacer correctement pour atteindre les cellules cancéreuses. Cette anomalie de migration est l'une des principales raisons expliquant l'échec des immunothérapies actuelles. Il est donc urgent de comprendre les mécanismes impliqués dans la migration des lymphocytes T afin de concevoir des stratégies renforçant cette fonction.
En utilisant la microscopie par imagerie dynamique, qui permet de suivre le déplacement des cellules, sur des modèles ex vivo, les chercheurs ont mis en évidence l’importance du métabolisme dans la migration intratumorale des lymphocytes T. Les résultats montrent que contrairement aux cellules cancéreuses, les cellules T n’utilisent pas l’énergie libérée par la dégradation du sucre dans le cytoplasme des cellules (glycolyse) pour se déplacer. En revanche, elles utilisent l’énergie provenant du métabolisme mitochondrial qui, au cœur de la cellule, est produite sous forme d'adénosine triphosphate (ATP). Ce dernier joue donc un rôle déterminant dans la migration des lymphocytes T. D’autres expériences ont permis d’identifier, en plus de l’ATP, les dérivés réactifs de l'oxygène (ROS) produits par les mitochondries comme éléments moteurs de la mobilité des cellules T.
Renforcer la motilité des cellules T au cœur des tumeurs
En utilisant des modèles murins dans l’étude du cancer du poumon, les auteurs ont également démontré qu’il était possible d’augmenter l’infiltration des cellules T dans les tumeurs en boostant leur métabolisme mitochondrial par des approches pharmacologiques. Cette stratégie a ensuite été appliquée à une immunothérapie qui repose sur l’utilisation de lymphocytes T, génétiquement modifiés, pour exprimer un récepteur à l’antigène. Ce dernier reconnaîtra spécifiquement les cellules cancéreuses afin de les détruire (cellules CAR-T). Les cellules CAR-T dont le métabolisme mitochondrial est augmenté ont présenté une meilleure capacité à entrer en contact avec les cellules tumorales avant de les éliminer.
Les résultats de cette étude fournissent de nouvelles perspectives pour comprendre comment le microenvironnement de la tumeur freine les déplacements des lymphocytes T. De plus, ils pourront aider à optimiser les stratégies d’immunothérapie actuelles en ciblant le métabolisme des cellules T afin de renforcer la motilité des cellules T.
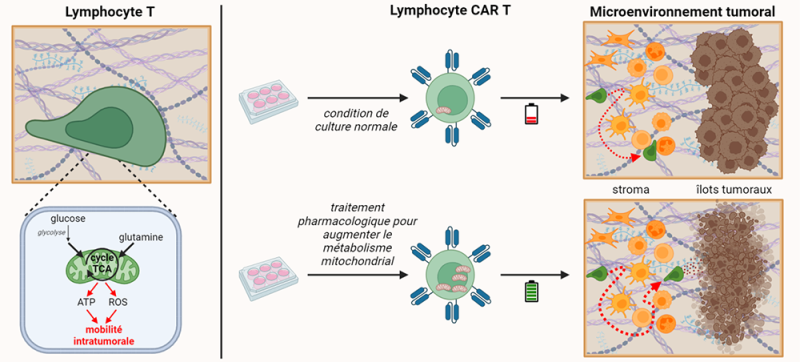
Figure : À gauche, l’activité de la mitochondrie alimentée par le glucose et la glutamine soutient la migration des cellules T via la production d’ATP et de dérivés réactifs de l'oxygène (ROS). A droite, les approches pharmacologiques utilisées pendant la culture in vitro pour augmenter le métabolisme mitochondrial des cellules CAR-T permettent à ces cellules de migrer activement dans les tumeurs afin d'atteindre les îlots tumoraux et de tuer efficacement les cellules cancéreuses.
En savoir plus :
Simula L, Fumagalli M, Vimeux L, et al. Mitochondrial metabolism sustains CD8+ T cell migration for an efficient infiltration into solid tumors. Nat Commun. 2024;15(1):2203. Published 2024 Mar 11. doi:10.1038/s41467-024-46377-7.
Contact
Laboratoire
Institut Cochin (CNRS/Inserm/Université Paris Cité)
22 Rue Mechain,
75104 Paris, France