Cancer de la prostate : rôle central du manque d’oxygène
Dans une étude parue dans la revue Science Advances, les scientifiques mettent en évidence le rôle central du manque d’oxygène dans la progression des lésions précancéreuses prostatiques. De plus, ils identifient une nouvelle cible thérapeutique pour ralentir l’évolution des tumeurs et un biomarqueur pronostique de rechutes après prostatectomie, ouvrant de nouvelles perspectives pour la prise en charge des patients.
Le cancer de la prostate est le cancer masculin le plus fréquent et la 3ème cause de mortalité par cancer dans les pays industrialisés. La prise en charge chirurgicale ou par radiothérapie des formes localisées permet la guérison d’un grand nombre de patients, mais peut affecter leur qualité de vie. De plus, les thérapies actuelles pour les stades métastatiques induisent de nombreux effets indésirables, et ont une efficacité limitée par l’apparition de résistances aux traitements.
Le cancer de la prostate se développant sur plusieurs décennies, des biomarqueurs permettant d’identifier précocement les tumeurs à haut risque de récidive et des stratégies prévenant ou ralentissant l’apparition de tumeurs agressives permettraient d’éviter des interventions chirurgicales et la résistance aux thérapies actuelles.
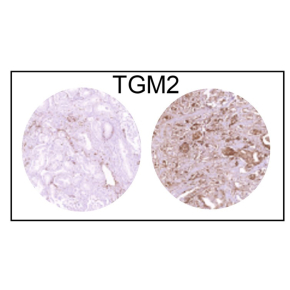
Dans cet article, les scientifiques cartographient les différents types cellulaires durant l’évolution des lésions précancéreuses de modèles murins de cancer de la prostate, à l’aide de techniques permettant de caractériser l’expression génique à l’échelle de cellules uniques. Ainsi, ils mettent en évidence que les glandes prostatiques précancéreuses sont rapidement en manque d’oxygène, conduisant à l’activation du facteur d’hypoxie HIF1A. Ce dernier va moduler le métabolisme des cellules épithéliales prostatiques ainsi que le recrutement de cellules immunitaires, et induire la transformation des cellules épithéliales prostatiques en cellules cancéreuses. De plus, les scientifiques montrent que l’inactivation de ce facteur ralentit l’évolution des tumeurs. Enfin, ces travaux permettent d’identifier TGM2 comme un biomarqueur de risque élevé de rechute après prostatectomie.
Ces résultats ouvrent donc de potentielles perspectives pour une meilleure prise en charge des patients atteints de cancer de la prostate.
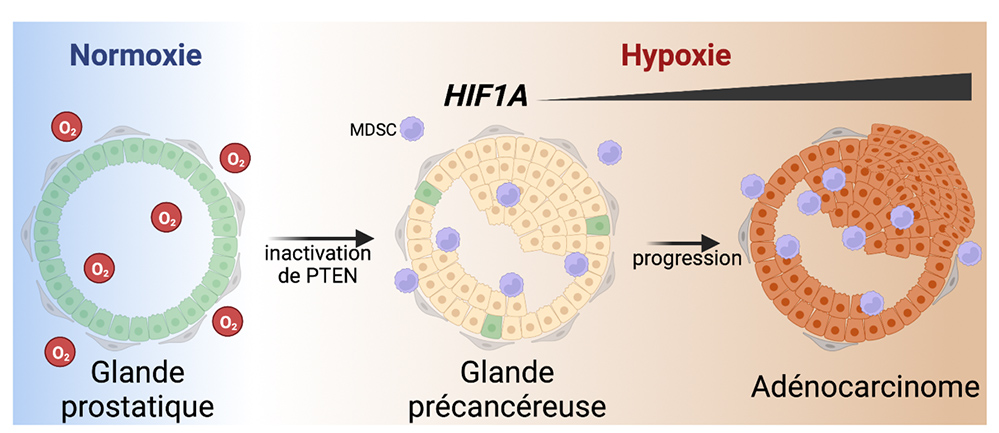
Figure : Suite à l’inactivation du gène suppresseur de tumeur PTEN dans les cellules épithéliales prostatiques de souris, les glandes deviennent hypoxiques conduisant à la stabilisation du facteur HIF1A. Ce dernier favorise la progression des lésions en adénocarcinome, en induisant la plasticité des cellules épithéliales et le recrutement de cellules immunitaires immunosuppressives (MDSC) (créée avec BioRender).
Pour en savoir plus :
Hypoxia-mediated stabilization of HIF1A in prostatic intraepithelial neoplasia promotes cell plasticity and malignant progression
M. A. Abu el Maaty, J. Terzic, C. Keime, D. Rovito, R. Lutzing, D. Yanushko, M. Parisotto, E. Grelet, I. J. Namer, V. Lindner, G. Lavernyand D. Metzger
Science Advances. 22 juillet 2022. DOI: 10.1126/sciadv.abo2295
Contact
Laboratoire
Institut de génétique et biologie moléculaire et cellulaire - IGBMC (CNRS/Inserm/Université de Strasbourg)
1 rue Laurent Fries, BP 10142
F- 67404 ILLKIRCH Cedex