Bora, le chef d’orchestre moléculaire qui déclenche l’entrée en mitose
Pour qu’une cellule se divise correctement, l’entrée en mitose doit être déclenchée avec une précision extrême. Dans une étude publiée dans EMBO Journal, des scientifiques révèlent un mécanisme inédit montrant comment la protéine Bora coordonne simultanément l’activation de deux kinases majeures, Aurora A et Plk1. Cette découverte éclaire une étape clé du cycle cellulaire, souvent dérégulée dans les cancers.
Entrer en mitose : une décision sous haute surveillance
La mitose est la phase du cycle cellulaire au cours de laquelle une cellule se divise en deux cellules filles génétiquement identiques. Cette étape implique une profonde réorganisation interne : condensation des chromosomes, formation du fuseau mitotique et séparation précise du matériel génétique.
Deux enzymes jouent un rôle central dans ce processus : les kinases mitotiques Aurora A et Plk1. Ces protéines fonctionnent comme des interrupteurs moléculaires, activés par l’ajout d’un groupement phosphate sur une région clé appelée boucle (ou segment) d’activation. Tant que cette modification n’a pas lieu, la kinase reste inactive.
On savait déjà qu’Aurora A active Plk1 en phosphorylant sa boucle d’activation. Mais un problème demeurait : en phase G2, juste avant la mitose, Aurora A est maintenue inactive par des phosphatases qui retirent systématiquement ses phosphates. Comment peut-elle alors s’activer suffisamment pour déclencher la mitose ?
C’est cette énigme que les scientifiques ont résolue dans un article publié dans la revue EMBO Journal en mettant en lumière le rôle central de Bora, une protéine dite intrinsèquement désordonnée, c’est-à-dire très flexible et capable d’interagir avec plusieurs partenaires.
Bora, un activateur de kinase complètement inédit
Grâce à des approches combinant biochimie, modélisation structurale (AlphaFold) et expériences fonctionnelles, les chercheurs montrent que :
- En phase G2, Bora est phosphorylée par le complexe Cycline A–Cdk1, qui coordonne la terminaison de la réplication et l’entrée en mitose.
- Cette phospho-Bora se fixe à Aurora A non phosphorylée et s’enroule autour de son domaine kinase.
- Elle positionne alors l’un de ses propres phosphates (sur le résidu S112) directement dans la boucle d’activation d’Aurora A.
Autrement dit, Bora fournit à Aurora A un phosphate par procuration. Ce mécanisme dit « en trans » remplace fonctionnellement l’autophosphorylation normalement requise et permet à Aurora A de devenir active malgré l’action des phosphatases.
Un trio moléculaire pour lancer la mitose
Bora ne s’arrête pas là. Elle agit aussi comme une plateforme de mise en contact :
- Elle se lie à Plk1 par une région conservée,
- Elle rapproche Aurora A activée de Plk1, qui est normalement un substrat peu efficace,
- Elle permet ainsi la phosphorylation de Plk1 sur sa propre boucle d’activation.
Bora coordonne donc l’activation en cascade d’Aurora A puis de Plk1, déclenchant de manière synchronisée l’entrée en mitose.
Une surexpression de Bora, de Plk1 et d’Aurora A est typiquement retrouvée dans divers types de cancers, et donc ces travaux pourraient permettre le développement d’inhibiteurs spécifiques, à visée thérapeutique, ciblant l’interface Plk1-Bora.
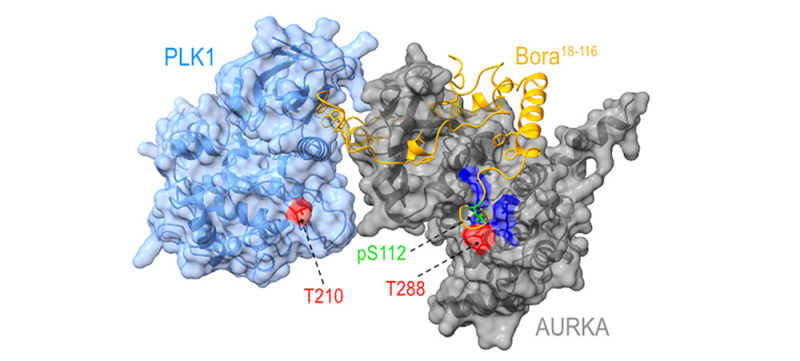
Figure : Bora coordonne l’activation des kinases mitotiques Aurora A et Plk1. Bora (orange, fragment 18-116), phosphorylé par Cycline A-Cdk1, entoure le domaine kinase d’Aurora A (gris) et vient positionner le phosphate situé sur le résidu S112 (vert) dans la boucle d’activation d’Aurora A. Ce phosphate, apporté « en trans » remplace fonctionnellement le phosphate normalement apporté « en cis » sur le résidu T288. Bora se fixe également à Plk1 (bleu ciel) par une région conservée et ancre ainsi Aurora A activée sur Plk1, ce qui favorise la phosphorylation de la boucle d’activation de Plk1 (T210).
En savoir plus : Pillan, A., Ormancey, P., Ben Choug, C. et al. Molecular basis for the activation of Aurora A and Plk1 kinases during mitotic entry. EMBO J (2026). https://doi.org/10.1038/s44318-025-00679-8
Contact
Laboratoire
Institut Jacques Monod - IJM (CNRS/Université Paris Cité)
15 rue Hélène Brion
75205 PARIS CEDEX 13
