Auto-intoxication du bacille de la tuberculose par une toxine ciblant la synthèse des protéines
Certaines bactéries produisent des toxines leur permettant de s’adapter à différents stress ou autres agressions du système immunitaire. Les scientifiques ont découvert une nouvelle toxine qui bloque la synthèse des protéines en inhibant la maturation des ARN de transfert chez Mycobacterium tuberculosis, l’agent responsable de la tuberculose. Cette étude publiée dans Nature Communications, a aussi permis d’identifier le mécanisme d’inhibition de la toxine par une nouvelle famille d’antidote.
La tuberculose est l’une des principales causes de mortalité due à un seul agent infectieux, la bactérie Mycobacterium tuberculosis. Cette bactérie affecte principalement les poumons et se transmet d'une personne à l'autre par voie aérienne. Elle peut persister longtemps chez l'hôte dans un état non-réplicatif et tolérant aux médicaments, appelé tuberculose latente. Les traitements sont longs, pas suffisamment efficaces et souvent associés à des effets secondaires. En outre, l'apparition de tuberculoses multi et ultrarésistantes a fortement accru le besoin d’identifier de nouvelles cibles, afin de développer de nouveaux médicaments et de nouvelles stratégies de traitement.
De façon remarquable, Mycobacterium tuberculosis possède dans son génome plus de 80 petits modules génétiques à deux composants appelés systèmes de toxine-antitoxine. Les systèmes Toxine-Antitoxine (TA) sont des éléments génétiques composés d'une toxine délétère et d'une antitoxine qui inhibe son activité et joue le rôle d’antidote. En condition de stress, l'inhibition par l'antitoxine est levée et les toxines actives peuvent cibler des structures cellulaires ainsi que des processus essentiels tels que la synthèse des protéines (traduction), la réplication, le métabolisme ou la synthèse de la paroi cellulaire, entraînant ainsi une inhibition de la croissance ou la mort cellulaire.
Chez certaines bactéries, le contrôle de la croissance par ces toxines est impliqué dans des mécanismes de défense contre les virus de bactéries (phages), dans la stabilisation des éléments génétiques, ainsi que dans la virulence bactérienne et la persistance en présence d’antibiotiques. A ce jour, on ne connaît pas le rôle de ces systèmes chez M. tuberculosis mais la nature hautement toxique de certaines toxines suggère que leurs nouvelles propriétés antibactériennes pourraient être utilisées pour identifier de nouvelles cibles thérapeutiques ou directement comme agents antimicrobiens.
Dans cette publication, les scientifiques montrent que la toxine MenT1 contrôle la croissance de M. tuberculosis en inhibant la synthèse des protéines par un mécanisme impliquant l’inhibition de l’aminoacylation des ARN de transfert en modifiant leur extrémité acceptrice. Les scientifiques ont aussi pu mettre en évidence le mécanisme d’inhibition de la toxine par l’antitoxine MenA1 et obtenu la structure tridimensionnelle du complexe entre MenT1 et MenA1.
Cette étude met en lumière le mécanisme de contrôle de la croissance du bacille de la tuberculose par cette toxine ainsi que celui aboutissant à son inhibition. Elle ouvre la voie au développement de traitements innovants reposant sur l’activation de la toxine MenT1 ou l’inactivation de l’antitoxine MenA1.
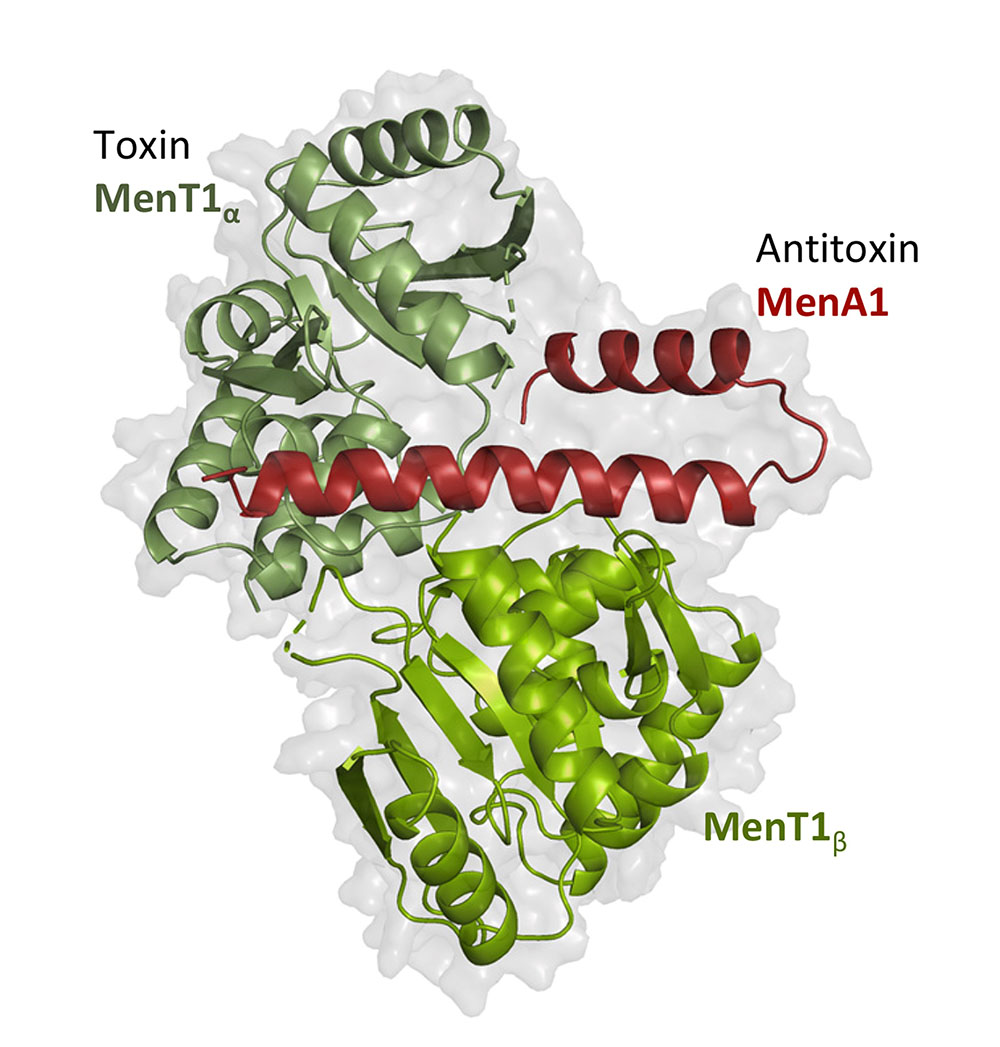
Figure : Inhibition de la toxine MenT1 par fixation asymétrique de l’antitoxine MenA1. Structure cristalline du complexe toxine-antitoxine MenT1α:MenA1:MenT1β chez Mycobacterium tuberculosis.
En savoir plus :
MenT nucleotidyltransferase toxins extend tRNA acceptor stems and can be inhibited by asymmetrical antitoxin binding
Xibing XU, Ben USHER, Claude GUTIERREZ, Roland BARRIOT, Tom J. ARROWSMITH, Xue HAN, Peter REDDER, Olivier NEYROLLES, Tim R. BLOWER, Pierre GENEVAUX
Nature Communications, In Press
Contact
Laboratoire
Laboratoire de microbiologie et de génétique moléculaires - LMGM (CNRS/Université Toulouse - Paul Sabatier)
Centre de biologie intégrative (CBI) de Toulouse
118 route de Narbonne
31062 Toulouse