Au cœur des cellules souches : comment les variants des histones protègent leur génome
Dans le noyau des cellules de mammifères, l’ADN doit être compacté pour tenir dans un espace restreint. Ce rôle est assuré par les histones, des protéines qui modulent l’organisation et l’activité du génome. Dans une étude publiée dans Nature Communications, des scientifiques ont montré l’importance de l’équilibre entre différents variants d’histones dans la stabilité nucléaire, particulièrement dans les cellules souches.
Dans le noyau, l’ADN est très long (plusieurs mètres dans une cellule de mammifères) et doit en conséquence être compacté. Cette compaction est assurée par les histones, des protéines autour desquelles l’ADN s’enroule pour former une structure appelée chromatine. Il existe plusieurs types d’histones qui remplissent des fonctions légèrement différentes.
Dans cette étude, publiée dans la revue Nature Communications, des scientifiques se sont intéressés à des variants de l’Histone H3 : H3.1 et H3.2, deux formes dites réplicatives car intégrées pendant la phase S du cycle cellulaire (synthèse d’ADN, moment où l’ADN est dupliqué) et H3.3, une forme dite de remplacement, car incorporée en dehors de la réplication (en absence de synthèse d’ADN), notamment dans les zones d’ADN actives.
Les scientifiques ont alors comparé l’incorporation de ces trois variants d’histones dans trois catégories de cellules de souris :
- Des cellules souches embryonnaires, cellules dites pluripotentes car à l’origine de toutes les cellules de l’organisme adulte,
- Des cellules souches neurales, déjà engagées dans une voie de spécialisation
- Des fibroblastes immortalisés, des cellules différenciées de la peau modifiées pour se multiplier à volonté en laboratoire.
Ils se sont intéressés à une zone particulière du génome : les chromocentres. Il s’agit de régions où l’ADN est très compacté et peu actif, formant ce qu’on appelle l’hétérochromatine. Ces régions jouent un rôle essentiel pour maintenir la stabilité du génome pendant la mitose.
Les résultats montrent que si le variant H3.1/2 est stable tout au long du cycle cellulaire dans les cellules différenciées, il est en revanche moins stable dans les cellules souches embryonnaires, probablement en lien avec leur plus grande plasticité et leur niveau élevé de transcription, même dans les chromocentres.
Pour tester la robustesse de ce mécanisme, les scientifiques ont modifié la dynamique naturelle des histones dans les chromocentres. En utilisant une autre protéine appelée HIRA, un chaperon d’histone, c’est-à-dire une protéine qui aide à placer H3.3 dans la chromatine, ils ont forcé l’intégration de H3.3 dans les chromocentres, normalement occupés par H3.1/2, en ciblant HIRA aux chromocentres.
Résultat : cette perturbation a eu des effets profonds sur les cellules souches embryonnaires. Des anomalies dans la forme du noyau, une désorganisation de la chromatine et des défauts dans la division cellulaire ont été observés, mettant en danger la survie de la cellule.
Ces travaux montrent que le bon équilibre entre les variants H3.1/2 et H3.3 est crucial pour le maintien d’une organisation nucléaire stable, en particulier dans les cellules souches. Les cellules utilisent différemment ces deux variants pour marquer certaines régions de leur génome. L’interprétation de ces résultats est que selon le contexte et le potentiel de différentiation cellulaire, une utilisation distincte des dépôts de H3.1 et H3.3 peut conduire à des différences de « marquage » de régions génomiques par différents variants d’histone.
Ce mécanisme pourrait également être en jeu dans certaines maladies liées à la chromatine ou dans des processus où le noyau devient instable comme lors du vieillissement ou dans certains cancers.
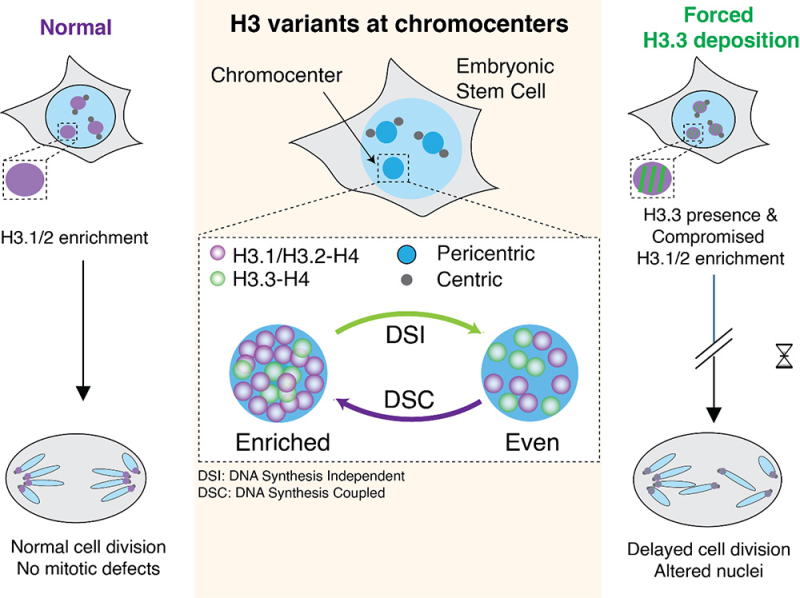
Figure : Représentation schématique de la dynamique des variants H3 au niveau des chromocentres. Au centre : Le dépôt des variants H3.1/2 et H3.3 aux chromocentres dans la chromatine des cellules souches embryonnaires est régulé par deux mécanismes de dépôt distincts, couplés à la synthèse de l'ADN (DSC) et indépendant de la synthèse de l'ADN (DSI), ce qui donne lieu à deux schémas principaux : enrichi en H3.1/2 et équilibré en H3.1/2-H3.3. À gauche : dans les cellules souches embryonnaires normales, l'enrichissement en H3.1/2 est produit par DSC et se maintient avant la division cellulaire. À droite : Forcer le dépôt de H3.3 par DSI conduit à une incorporation continue de H3.3, perturbant l'enrichissement physiologique de H3.1/2 aux chromocentres. Cette interférence entraîne des défauts de morphologie nucléaire et une altération de la progression du cycle cellulaire.
Pour en savoir plus : Arfè S, Karagyozova T, Forest A, Bingham D, Hmidan H, Mazaud D, Garnier M, Le Baccon P, Meshorer E, Quivy JP, Almouzni G. H3.3 deposition counteracts the replication-dependent enrichment of H3.1 at chromocenters in embryonic stem cells. Nat Commun. 2025 Jun 3;16(1):5138. doi: 10.1038/s41467-025-60430-z. PMID: 40461574; PMCID: PMC12134209.
Contact
Laboratoire
Dynamique du noyau (CNRS/Institut Curie/Sorbonne Université)
Institut Curie - Pavillon Pasteur
26 rue d'Ulm
75248 Paris Cedex 05