Antidépresseurs et douleurs chroniques, cibler le chlore fait la différence
Les douleurs chroniques neuropathiques touchent 8% de la population en France et sont très mal traitées. Les molécules de la famille des antidépresseurs font parties des traitements de première ligne mais leur efficacité reste limitée. Dans cet article publié dans la revue Science Advances, les scientifiques révèlent un mécanisme qui explique cette efficacité limitée et montrent que l’association d’un antidépresseur avec un amplificateur des transporteurs au chlore produit une analgésie robuste et durable.
Les douleurs chroniques neuropathiques sont associées à des lésions nerveuses qui touchent 8% de la population en France. A l’exception des antiépileptiques et des antidépresseurs dits tricycliques (TCA) ou des inhibiteurs de recapture de la sérotonine et de la noradrénaline (IRSN) qui ont une efficacité très partielle, il n’existe pas de traitement efficace sans effets secondaires graves.
Parmi les cibles des antidépresseurs, les neurones à sérotonine sont une cible privilégiée car ils projettent sur la moelle épinière et contrôlent la transmission des messages nociceptifs. Dans le cadre d’une collaboration avec l’Université Laval au Québec, les scientifiques se sont concentrés sur l’étude de ces neurones et ont utilisé des techniques modernes d’optogénétique pour spécifiquement stimuler ces populations de neurones à sérotonine avec de la lumière. Ils montrent que l’activation de ces populations de neurones induit une augmentation du seuil de perception nociceptif chez des souris naïves mais diminue ce seuil sur des souris neuropathiques pour lesquelles le seuil est déjà très bas. Ces neurones seraient donc capables de produire une analgésie endogène chez des souris naïves mais induiraient une hyperalgésie chez les souris neuropathiques. Cette hyperalgésie est directement associée à un déséquilibre du chlore au niveau de la moelle spinale due à une diminution des transporteurs de type KCC2 et qui perturbe les signaux nociceptifs avant leur perception en tant que douleur. Ces résultats permettent d’expliquer pourquoi les inhibiteurs spécifiques de la recapture de la sérotonine (dits IRSS) comme le prozac@ sont inefficaces chez les patients souffrant de douleurs chroniques neuropathiques, mais également la faible efficacité des autres familles d’antidépresseurs. Finalement, les scientifiques montrent que l’association d’un IRSS avec une molécule capable d’amplifier l’extrusion du chlore des cellules, rétablit chez des souris neuropathiques, l’effet analgésique de la sérotonine observé chez les souris naïves. Ces résultats (qui font l’objet d’un dépôt de brevet), permettent de proposer une association antidépresseur et amplificateur du chlore comme traitement des symptômes douloureux chez les patients atteints de douleurs chroniques neuropathiques.
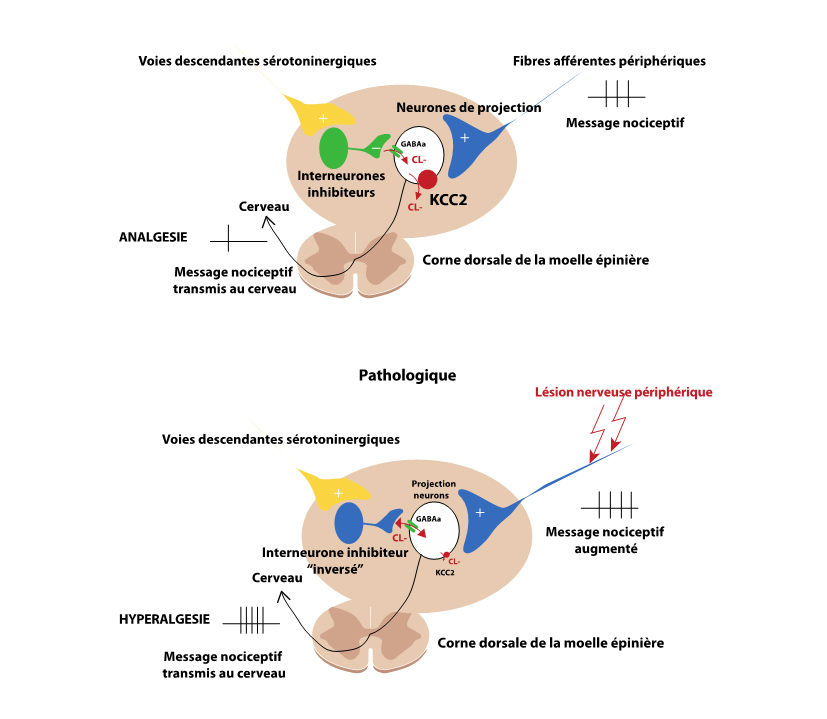
Figure : Les voies descendantes à sérotonine contrôlent la transmission nociceptive au niveau de la corne dorsale de la moelle épinière. Chez les individus sains (schéma du haut), ce contrôle s’effectue par une activation d’interneurones locaux inhibiteurs (en vert) diminuant la transmission nociceptive en inhibant les neurones de projection (en noir et blanc) qui envoient les messages vers le cerveau où la douleur sera perçue. Dans un contexte pathologique (schéma du bas), après lésion nerveuse par exemple, l’expression des transporteurs au chlore de type KCC2 est diminuée, les interneurones inhibiteurs (en bleu) ne peuvent plus inhiber les neurones de projection et les voies descendantes à sérotonine n’exercent plus d’action analgésique mais au contraire renforce l’hyperalgésie. En rééquilibrant le chlore spinal retrouve l’analgésie observées chez les individus sains. En associant un antidépresseur qui augmente les niveaux de sérotonine spinaux et un activateur des KCC2, on obtient une puissante analgésie dans un modèle de neuropathie périphérique.
Pour en savoir plus :
Switch of serotonergic descending inhibition into facilitation by a spinal chloride imbalance in neuropathic pain.
Aby F, Lorenzo LE, Grivet Z, Bouali-Benazzouz R, Martin H, Valerio S, Whitestone S, Isabel D, Idi W, Bouchatta O, De Deurwaerdere P, Godin AG, Herry C, Fioramonti X, Landry M, De Koninck Y, Fossat P.
Science Advances 29 juillet 2022. doi: 10.1126/sciadv.abo0689
Contact
Laboratoire
Institut des maladies neurodégénératives - IMN (Université de Bordeaux/CNRS)
146 rue Leo Saignat
33076 Bordeaux Cedex
