Altération des neurones du toucher à l'origine des démangeaisons liées à l’autisme
Chez les personnes atteintes de troubles du spectre autistique, la peau peut se révéler étonnamment sensible : démangeaisons, réactions au moindre contact, inconfort au quotidien… Une étude menée chez la souris et publiée dans Translational Psychiatry, montre qu’un dysfonctionnement de neurones sensoriels, responsables de la perception du toucher agréable, pourrait être impliqué dans ces troubles cutanés. Ces résultats démontrent la nécessité de poursuivre les recherches afin d’ouvrir la voie à de nouvelles pistes thérapeutiques.
Troubles du spectre autistique et démangeaisons
Démangeaisons persistantes, peau hypersensible, réactions exacerbées au moindre contact… Ces symptômes, bien connus dans certaines maladies cutanées comme l’eczéma, sont également fréquents chez les personnes atteintes de troubles du spectre autistique (TSA). Longtemps considérés comme indépendants des difficultés sociales et comportementales caractéristiques de l’autisme, des scientifiques, dans un article publié dans la revue Translational Psychiatry montrent que ces troubles cutanés pourraient être liés aux mêmes changements sensoriels que ceux qui influencent la perception du toucher dans l’autisme.
Pour étudier ce phénomène, l’équipe a utilisé des souris porteuses d’une mutation du gène Shank3, associée à une forme d’autisme chez l’humain, le syndrome de Phelan-McDermid. Ces souris réagissaient en se grattant beaucoup en réponse à une déformation cutanée ou à une stimulation mécanique ponctuelle (application d’un filament fin sur la peau), alors que les souris ne portant pas la mutation n’avaient pas de réaction. Ces résultats suggéraient une hypersensibilité aux démangeaisons.
Le rôle clé des fibres sensorielles périphériques
Pour comprendre ce phénomène, les scientifiques se sont intéressés aux neurones sensoriels cutanés chargés de détecter le toucher. Ils n’ont observé aucune différence dans leur nombre mais ont noté une modification de leur morphologie. Celle-ci se produit au niveau des fibres spécialisées dans la perception du toucher léger et agréable (comme une caresse) appelées fibres C mécanorécepteurs à bas seuils (C-LTMRs). Leurs prolongements étaient plus longs et anormalement étendus jusque dans les couches superficielles de la peau du dos.
Des enregistrements électrophysiologiques ont confirmé ce constat : ces fibres présentaient une sensibilité réduite en réponse à une déformation du tissu cutané. Bien que ces fibres soient normalement spécialisées dans la perception du toucher agréable, il semblerait que leur altération favorise une hypersensibilité aux démangeaisons.
L’analyse de gènes exprimés par les C-LTMRs a révélé une diminution de l’expression de TAFA4, une protéine sécrétée par ces neurones, connue pour aider à calmer la douleur et l’inflammation. Pour tester son rôle, les chercheurs ont administré la protéine aux souris mutantes. Le grattage spontané en réponse aux stimulations mécaniques a été nettement réduit, sans pour autant restaurer totalement leur sensibilité. Des caresses douces sur la peau avaient un effet apaisant similaire.
Les chercheurs ont donc recherché l’implication d’autres fibres. L’inhibition pharmacologique des fibres Aβ-LTMRs, traditionnellement associées à la détection de pressions légères, a supprimé l’hypersensibilité au grattage, indiquant qu’elles participaient à l’induction de ces démangeaisons mécaniques dans ce modèle murin.
Ces résultats démontrent que les fibres sensorielles périphériques jouent un rôle clé dans les anomalies tactiles et cutanées observées dans les TSA, jusque-là principalement attribuées à des altérations des circuits neuronaux centraux. Deux mécanismes complémentaires semblent impliqués : d’une part, une dérégulation de la sécrétion locale de TAFA4 par les C-LTMRs, qui accentue les réactions de grattage ; d’autre part, un processus indépendant de TAFA4 mais lié à l’intégrité fonctionnelle de ces fibres.
En révélant l’importance des dysfonctionnements périphériques dans l’hypersensibilité tactile de l’autisme, cette étude ouvre des pistes prometteuses. Des approches combinant thérapies pharmacologiques ciblant TAFA4 et stimulations sensorielles douces, comme la caresse, pourraient à terme contribuer à atténuer les démangeaisons et améliorer la qualité de vie des personnes autistes.
« Ces travaux montrent que la peau et les neurones sensoriels sont au cœur des troubles cutanés liés au TSA », concluent les auteur(e)s. Une découverte qui souligne combien, dans l’autisme, les altérations perceptives sont incarnées jusque dans la peau, à l’interface entre le corps et l’environnement.
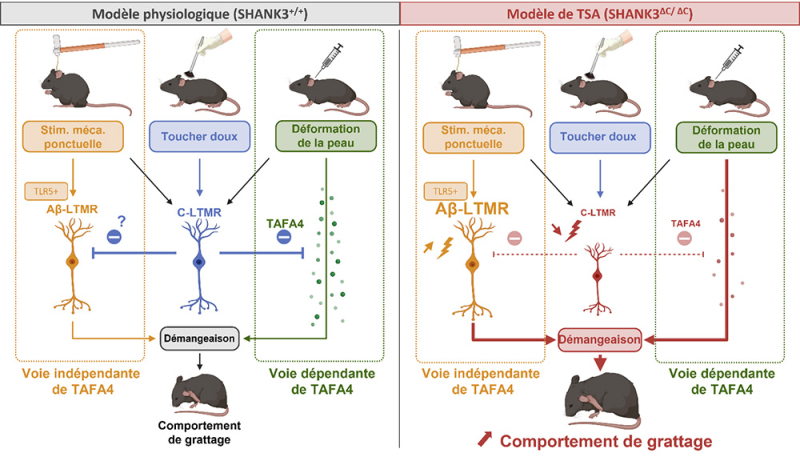
Figure : Schéma hypothétique de deux voies différentes impliquées dans le contrôle de la démangeaison et de la réponse de grattage chez les souris Shank3ΔC/ΔC. Nos expériences ont identifié deux voies distinctes pour le comportement de grattage en réponse à des stimuli tactiles : la stimulation mécanique ponctuelle (définie comme une pression mécanique directe et externe, mise en évidence en orange) et la déformation cutanée (caractérisée par une distorsion mécanique localisée, par exemple après une injection intradermique, mise en évidence en vert). La réponse à la stimulation mécanique ponctuelle est principalement médiée par les fibres Aβ-LTMRs exprimant TLR5 et est hypersensible chez les souris Shank3ΔC/ΔC, ce qui conduit à un phénotype d'alloknésie (réponses mécaniques excessives à la démangeaison). En revanche, la déformation cutanée induit le grattage, qui peut être atténué par le TAFA4 chez les souris Shank3ΔC/ΔC. Cependant, le TAFA4 ne réduit pas l'alloknésie, ce qui suggère que la réponse à la déformation cutanée dépend du TAFA4, tandis que la réponse mécanique à la démangeaison est indépendante du TAFA4. Les souris Shank3ΔC/ΔC, présentant un déficit de fonctionnalité des fibres C-LTMRs, montrent une sensibilité accrue aux démangeaisons dans les deux cas. Une supplémentation en TAFA4 n'a permis de récupérer que la réponse spontanée de grattage à la déformation cutanée chez les souris Shank3ΔC/ΔC, mais pas leur hypersensibilité à l'alloknésie.
En savoir plus : Huzard D, Oliva G, Marias M, Granat C, Soubeyre V, do Nascimento Pereira G, Negm A, Grellier G, Devaux J, Bourinet E, François A. Primary sensory neuron dysfunction underlying mechanical itch hypersensitivity in a Shank3 mouse model of autism. Transl Psychiatry. 2025 Jul 28;15(1):259. doi: 10.1038/s41398-025-03461-w. PMID: 40721421; PMCID: PMC12304312.
Contact
Laboratoire
Institut de génomique fonctionnelle (IGF) - (Inserm/CNRS/Université de Montpellier)
141 rue de la Cardonille
34094- Montpellier Cedex5