80 % de toutes les protéines du SRAS-CoV-2 produites en laboratoire
Pour le développement de médicaments ou de vaccins contre le COVID-19, la recherche a besoin de protéines virales d'une grande pureté. Pour la plupart des protéines du SRAS-CoV-2, les scientifiques ont maintenant mis au point des protocoles qui permettent de produire plusieurs milligrammes de chacune de ces protéines avec une grande pureté. Les protocoles de laboratoire et les outils génétiques nécessaires sont librement accessibles aux chercheurs du monde entier, et sont publié en libre accès dans la revue Frontiers in Molecular Biosciences.
Lorsque le virus du SRAS-CoV-2 mute, cela peut entraîner l'échange d'un acide aminé à un endroit particulier d'une protéine virale. Afin d'évaluer rapidement l'effet de cette modification, une image tridimensionnelle de la protéine virale est extrêmement utile. En effet, elle montre si le changement d'acide aminé a des conséquences sur la fonction de la protéine ou sur l'interaction avec un médicament ou un anticorps potentiel.
Dans le cadre d'un réseau international impliquant 36 laboratoires issus de l'université Goethe de Francfort, du CNRS de Lyon et de l'université technique de Darmstadt, les scientifiques, dès le début de la pandémie, ont visé un objectif: décrire les structures tridimensionnelles des molécules du SRAS-CoV-2 à l'aide de la spectroscopie par résonance magnétique nucléaire (RMN). Dans la spectroscopie RMN, les molécules sont d'abord marquées avec des types d'atomes particuliers (isotopes), puis exposées à un champ magnétique puissant. La RMN peut alors être utilisée pour étudier en détail et à haut débit la manière dont les composés potentiellement actifs se lient aux protéines virales.
Le réseau COVID-19 NMR Consortium (https://covid19-nmr.de/), coordonné par le professeur Harald Schwalbe de l'Institut de chimie organique et de biologie chimique de l'université Goethe, a des participants du monde entier.
Toutefois, la condition préalable fondamentale est de produire de grandes quantités de protéines très pures et stables, et correctement repliées, pour le grand nombre de tests. Grâce à l'expertise de 129 collègues (https://covid19-nmr.de/participants/), il est désormais possible de produire et de purifier 23 des quelque 30 protéines du SRAS-CoV-2, entièrement ou sous forme de fragments pertinents, "en éprouvette" et en grande quantité. À cette fin, les gènes codant ces protéines ont été incorporés dans des plasmides exprimés dans des bactéries, ou encore, pour les protéines plus complexes, dans un système acellulaire basé sur des extraits de germe de blé. En effet, les protéines du SRAS-CoV-2 qui présentent des caractéristiques plus complexes, comme par exemple les protéines associées à la membrane, sont difficiles à produire par expression bactérienne. Dans ce cas, les approches acellulaires sont très utiles et, dans le contexte des virus humains, ce sont les systèmes impliquant le ribosome eucaryote du blé qui sont les plus fonctionnels. Dans tous les cas, La spectroscopie RMN permet de vérifier si les protéines sont encore correctement repliées après leur isolement et leur enrichissement.
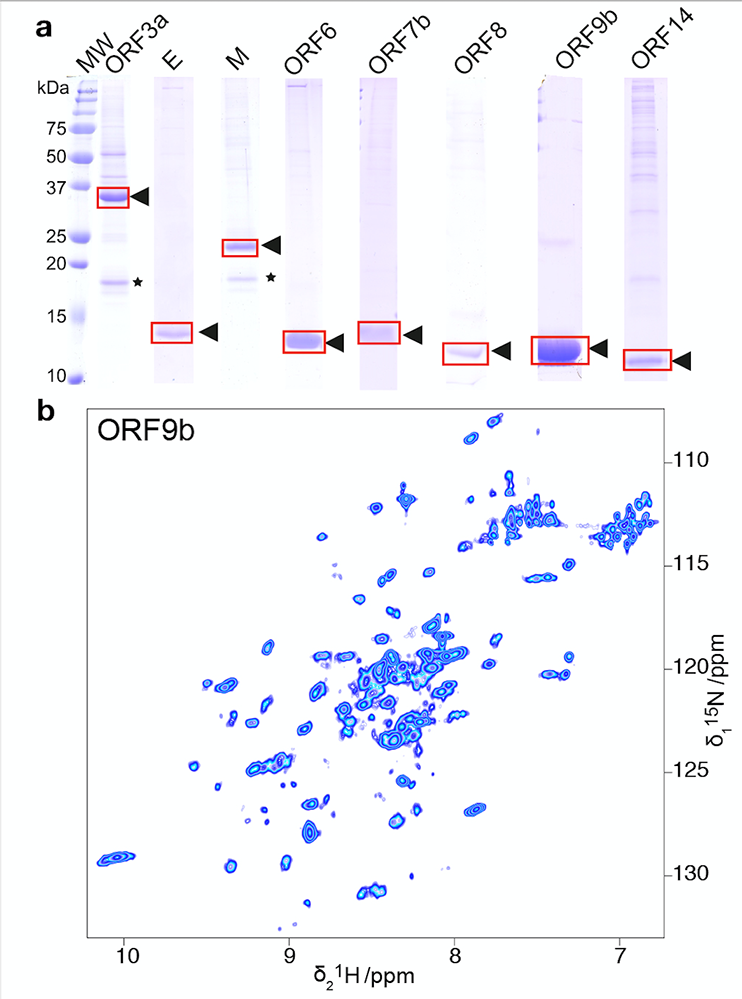
Figure : a) Les protéines structurales et accessoires issues de la synthese acellulaire, produits pour les protéines membranaires en présence de détergents. b) Spectre RMN de ORF9b.
Pour en savoir plus :
Large-scale recombinant production of the SARS-CoV-2 proteome for high-throughput and structural biology applications
Nadide Altincekic, Sophie Marianne Korn, Nusrat Shahin Qureshi, Marie Dujardin, Martí Ninot-Pedrosa et. al..
Frontiers in Molecular Biosciences. 10 mai 2021 https://doi.org/10.3389/fmolb.2021.653148
Contact
laboratoire
Molecular Microbiology and Structural Biochemistry (CNRS Université de Lyon 1)
7, passage du Vercors
69367 Lyon Cedex 07
Université Goethe de Francfort-sur-le-Main