Visualisation des "mouvements respiratoires" des structures protéiques
En combinant la spectroscopie par résonance magnétique nucléaire (RMN) et la cristallographie aux rayons X, les scientifiques révèlent les changements structurels associés aux rotations des cycles aromatiques dans le cœur hydrophobe d'une protéine. Ces résultats, publiés dans la revue Nature, résolvent un paradoxe de longue date en chimie des protéines et constituent une avancée fondamentale dans la compréhension de la dynamique des protéines.
Les protéines ne sont pas des structures rigides : elles bougent, "respirent" et s’adaptent à leur environnement afin d’optimiser leurs formes et leurs activités. Pressentie dès les années 70 par des études de résonance magnétique nucléaire (RMN), l’existence de « mouvements respiratoires » par lesquels les protéines ajustent leurs formes est démontrée et rendue visible par les travaux de pointe en biologie structurale. En combinant la spectroscopie RMN et la cristallographie aux rayons X, les scientifiques ont cartographié les changements structurels, à une résolution atomique, associés aux rotations des anneaux aromatiques des acides aminés situés dans le cœur d'une protéine. L'étude résout un paradoxe de longue date en chimie des protéines en montrant comment un volume vide est généré autour de l’acide aminé aromatique pour permettre la rotation de sa chaîne latérale tout en maintenant le repliement de la protéine.
Cette découverte éclaire d’un jour nouveau la façon dont les changements dans l'équilibre délicat des interactions qui stabilisent le cœur hydrophobe peuvent entraîner une réorganisation majeure de la structure de la protéine. En outre, elle offre une perspective sur la manière dont de nouvelles fonctions biologiques peuvent être acquises au cours de l'évolution par des modifications du réseau d'interactions dans le cœur des protéines. Grâce à cette capacité de « voir » ce qui se passe au centre des structures des protéines en mouvement, on comprend mieux comment de très petites altérations peuvent être la base de nombreuses maladies.
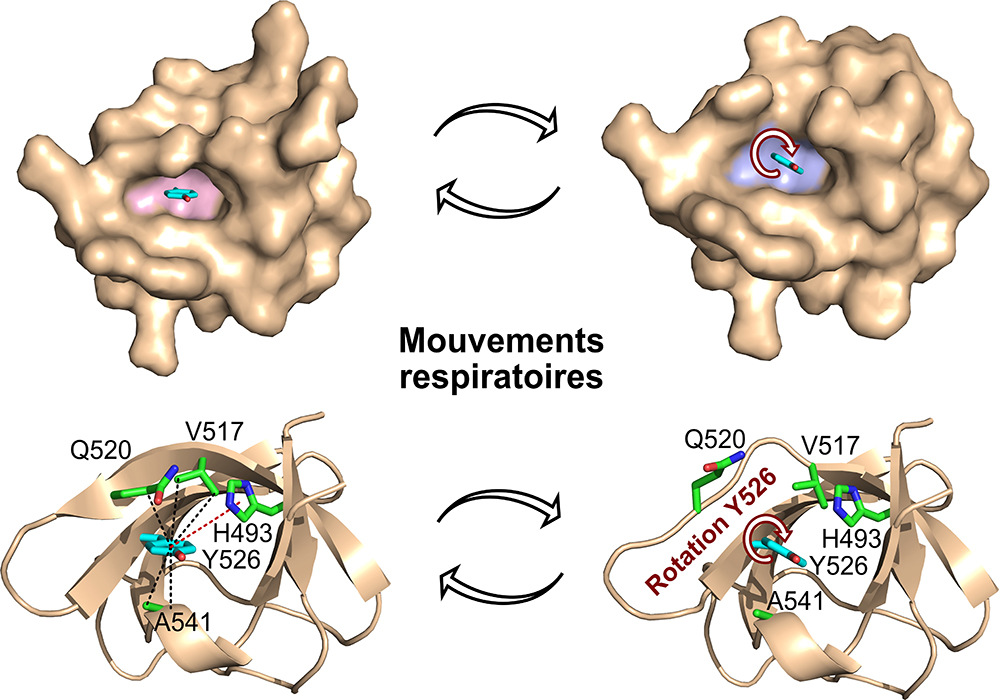
Figure : Visualisation des mouvements respiratoires associés aux rotations de l'anneau aromatique de la tyrosine 526 (Y526) dans le domaine SH3 de la protéine JIP1. Un volume vide est créé autour de l'anneau par des changements structurels distincts permettant aux rotations de l'anneau d'avoir lieu.
Pour en savoir plus :
Visualizing protein breathing motions associated with aromatic ring flipping
Mariño Pérez L, Ielasi FS, Bessa LM, Maurin D, Kragelj J, Blackledge M, Salvi N, Bouvignies G, Palencia A, Jensen MR
Nature 16 février 2022. doi: https://doi.org/10.1038/s41586-022-04417-6
Contact
Laboratoires
Institut de biologie structurale (CNRS, CEA, Université Grenoble Alpes)
71, avenue des Martyrs
CS 10090
38044 Grenoble CEDEX 9
Institut pour l’avancée des biosciences (CNRS, Inserm, Université Grenoble Alpes)
Site Santé
Allée des Alpes
38700 La Tronche